Стволовые клетки могут успешно заменить умершие клетки мозга

Исследователи Мюнхенского университета Людвига-Максимилиана, Института нейробиологии имени Макса Планка, а также исследовательского Центра им. Гельмгольца в Мюнхене продемонстрировали, что у мышей пересаженные нейроны, полученные из эмбриональных клеток, действительно могут быть включены в существующую сеть и правильно выполнять задачи, за которые отвечали поврежденные клетки. Эта работа имеет большое значение в потенциальном лечении всех приобретенных заболеваний головного мозга, включая инсульты, травмы, нейродегенеративные заболевания вроде болезней Альцгеймера или Паркинсона. Каждый из этих недугов приводит к необратимой потере нервных клеток и пожизненному неврологическому дефициту.
Когда речь заходит о восстановлении, например, после инсульта, у мозга взрослого человека очень мало возможностей для компенсации утраченных нервных клеток. Поэтому врачи и исследователи в области биомедицины изучают возможность использования пересаженных нервных клеток, чтобы заменить нейроны, которые пострадали в результате травмы или болезни. Предыдущие исследования показывают, что существует возможность устранить по крайней мере некоторые клинические симптомы посредством трансплантации фетальных нервных клеток в поврежденные нейронные сети. Однако процесс получения фетальных клеток порождает множество этических вопросов, поскольку добыть этот биоматериал можно только из плода после аборта, примерно на 9–12 неделе беременности. Кроме этого, до конца не ясно, смогут ли пересаженные неповрежденные нейроны достаточно хорошо интегрироваться, чтобы восстановить функции нейронной сети.
В ходе исследования, опубликованного в журнале Nature 26 октября, ученые выяснили, можно ли пересадить эмбриональные нервные клетки так, чтобы они удачно интегрировались в нейронную сеть и функционировали в зрительной коре головного мозга взрослых мышей. «Мы так много знаем о функциях нервных клеток в этой области, что можем легко оценить, действительно ли имплантированные клетки выполняют те задачи, которые возложены на нейронную сеть» — отмечает профессор Марк Хюбенер, один из руководителей исследования. Хюбенер специализируется на структуре и функциях зрительной системы млекопитающих.
В своих экспериментах команда исследователей пересаживала эмбриональные клетки в пораженные области зрительной зоны взрослых мышей. В течение следующих месяцев они наблюдали за поведением имплантированных незрелых нейронов с помощью двухфотонной микроскопии. Этот метод помог выяснить, дифференцируются ли они в так называемые «пирамидальные клетки» — возбудительные нейроны. Тот факт, что клетки выжили и продолжали развиваться, является весьма обнадеживающим. Все стало интереснее, когда исследователи внимательнее изучили электрическую активность трансплантированных клеток. Совместное исследование аспиранта Сюзанны Фолкнер и
постдока Софии Грейд показало, что новые клетки сформировали синаптические связи, которые обычно устанавливаются между клетками сети, и ответили на визуальные стимулы.
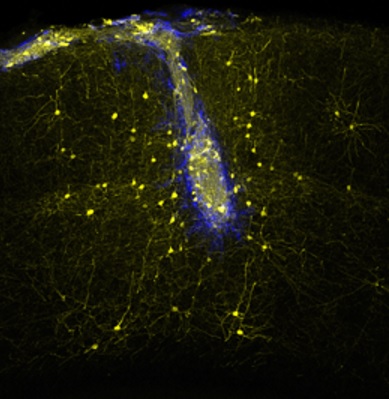
На изображении видно, как нервные трансплантанты (синего цвета) связываются с неповрежденными участками сети (желтого цвета)
Затем команда продолжила изучать установленные связи после пересадки нейронов. Они обнаружили, что пирамидальные клетки, полученные из трансплантированных зрелых нейронов, образовали функциональные связи с соответствующими нервными клетками по всему мозгу. Другими словами, они благополучно заняли место своих предшественников. Кроме того, они были в состоянии обрабатывать поступающую информацию и передать ее дальше по сети. «Эти результаты показывают, что имплантированные нервные клетки с исключительной точностью объединялись в нейронную сеть, в которую, при нормальных условиях, никогда не включились бы новые нервные клетки» — объясняет профессор Магдалена Гётц, работа которой заключалась в поиске способов замены утраченных нейронов в центральной нервной системе. Новое исследование показывает, что незрелые нейроны способны правильно реагировать на сигналы в мозге взрослых млекопитающих и могут закрывать функциональные «пробелы» в существующей нейронной сети.
Одним из главных плюсов трансплантации именно эмбриональных стволовых клеток заключается в том, что они не вырабатывают антигены тканевой совместимости. Когда наборы антигенов у донора и реципиента не совпадают, это приводит к отторжению клеток. Но в случае с трансплантацией ЭСК этого не происходит, и шанс, что клетки приживутся, обычно очень велик. Однако ученые выяснили, что существуют механизмы, которые могут помешать приживлению новых клеток.
Процесс создания нейронов из стволовых клеток и клеток-предшественников получил название «нейрогенез». Ученые показали, что на дальнейшую судьбу нейронов-новичков значительное влияние оказывают эпигенетические механизмы, которые вступают в игру на ранних стадиях нейрогенеза. Эти механизмы влияют на наследуемые изменения в фенотипе или экспрессии генов, но при этом не приводят к изменению последовательности в ДНК. Чтобы выяснить, какое значение ранние эпигенетические модификации оказывают на развитие нервных клеток во время эмбриогенеза у мышей, Магдалина Гётц и её коллеги целенаправленно заблокировали активность гена UHRF1. Ген управляет многими эпигенетическими функциями, в том числе и метилированием ДНК — модификацией молекулы ДНК без влияния на последовательность нуклеотидов. Метилирование определенных оснований нуклеотида в ДНК часто служит для того, чтобы «выключать» определенные гены.
Блокировка UHRF1 в передней области мозга крыс привела к активации ретровиральных элементов в геноме, которые до этого подавлялись метилированием. Активация вызвала накопление ретровиральных белков в пораженных клетках и дерегулированию генов. Это, в свою очередь, привело к прогрессирующим нарушениям в жизненно важных клеточных процессах и ускорило массовую гибель клеток. Результаты этого исследования показали, что даже такие факторы, которые действуют только в самом начале нейрогенеза, способны оказывать влияние на судьбу клеток, которое может проявиться только недели спустя.
