Малярия: конец истории?
От малярии ежегодно погибает около 3 миллионов людей. В основном ей болеют на Африканском континенте, в Южной и Юго-Восточной Азии, а также в странах Латинской Америки.
Химиотерапия, с помощью которой можно убить малярийный плазмодий, эффективна, но существуют 2 проблемы. Во-первых, паразитическое простейшее очень быстро вырабатывает устойчивость к лекарственным средствам. Во-вторых, у малярийного плазмодия сложный жизненный цикл, и особи на разных его стадиях имеют разную чувствительность к используемым препаратам. Так, некоторые виды плазмодия, вызывающие ovale- и vivax-малярию (т.е. Plasmodium ovale и Plasmodium vivax), заражая клетки печени, впадают в них в «спячку», в результате чего спустя некоторое время после казавшегося излечения наступает рецидив — болезнь возвращается, так как «спящий» паразит просыпается.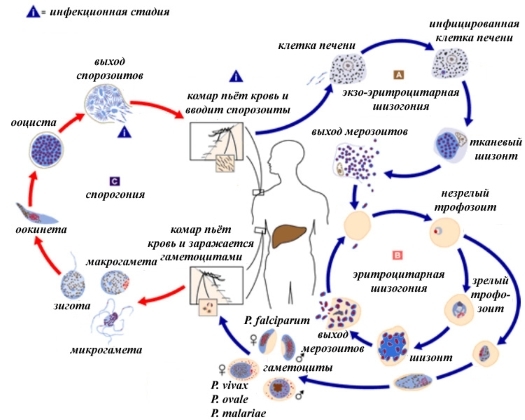
К сожалению, пока вакцины от малярии не существует, поэтому химиотерапия является единственным методом лечения, который, однако, всё чаще и чаще терпит неудачу.
Тем не менее, благодаря сочетанию современных методов органического синтеза, скрининга и молекулярной биологии, группе учёных, объединивших исследователей из Америки, Индии, Англии, Канады, Австралии, Голландии и Японии удалось найти молекулу, которая высоко активна в отношении многих стадий жизненного цикла малярийного плазмодия и обладает хорошими фармакокинетическими характеристиками, что делает её неплохим кандидатом для клинических испытаний.
Одним из продуктивных походов к созданию лекарственных средств является скрининг — определение активности огромного числа соединений, образующих так называемую библиотеку. Для наработки библиотеки используют реакции, в ходе которых возможно гладкое образование большого числа сходных соединений с различными заместителями.
Стратегию современного подхода к созданию библиотек можно описать словами, которые на русский можно перевести как «строй, соединяй, замыкай» (build-couple-pair). Суть этого подхода в следующем. На первой стадии («строй») синтезируют строительные блоки содержащие хиральные центры и несколько функциональных групп или реакционных центров, чтобы их можно было использовать на следующих стадиях. На второй стадии («соединяй») разнородные строительные блоки вводят в реакцию друг с другом. В заключении подвергают получившиеся соединения (так называемые конъюгаты) внутримолекулярной циклизации (стадия «замыкай»), внутримолекулярно связывая функциональные группы и реакционные центры.
После того, как библиотека получена, надо прогнать её через скрининговое решето, т.е. отделить активные молекулы от неактивных. В данном случае было не одно решето, а несколько. Первое пропускало молекулы, которые были активны в отношении эритроцитарной формы лекарственно устойчивого штамма наиболее опасного вида малярийного плазмодия Plasmodium falciparum, вызывающего так называемую тропическую малярию. Эритроцитарная стадия — это стадия развития малярийного плазмодия, на которой он собственно и вызывает симптомы болезни. Именно её в первую очередь и надо лечить.
Вещества испытывали в концентрации 10 мкМ (10 микромолей на литр). Из 100 000 соединений через это решето смогло пройти около 1500 молекул.
Важно отметить следующее.
На сегодняшний день существует несколько классов противомалярийных агентов, действующих на разные молекулярные мишени паразита. Если плазмодий устойчив к одному препарату класса, то с высокой вероятностью он будет устойчив и к остальным препаратам этого класса. Поэтому в подобного рода скрининговых исследованиях важно отсеять те новые молекулы, которые действуют на уже известные мишени. С этой целью прошедшие первичный скрининг молекулы испытывали на штаммах плазмодия, устойчивых к используемым препаратам, чтобы не изобретать заведомо бракованный велосипед.
Далее с отобранными молекулами работали следующим образом.
Во-первых, проверяли их на активность в отношении экзоэритроцитарной (внеэритроцитарной) печёночной формы паразита (тканевых шизонтов). Вещества испытывали в 4 концентрациях. Отбор проходили те, для которых EC5050>40 мкМ (концентрация, при которой погибало 50% клеток печени). Кроме тканевых шизонтов, которые заражают клетки печени в инкубационный период, и эритроцитарной стадии, на которой появляется характерный симптом малярии — перемежающаяся лихорадка, существуют ещё и гаметоциты — стадия половых клеток. Это так называемая трансмиссивная стадия, так как именно гаметоциты попадают в здорового малярийного комара, если он выпьет крови больного малярией человека. Уничтожение гаметоцитов не облегчит страдания больного, но будет важным бонусом в борьбе с распространением малярии, так как обрывает путь её передачи от больного к переносчику. Вот почему на 2 стадии скрининга молекул проверили также на активность в отношении гаметоцитов.
Так что же в итоге?
В результате всех этих мытарств было обнаружено соединение, которое in vitro (т.е. в стекле, в пробирке) было активно в отношении 3 жизненных форма паразита: эритроцитарных и тканевых шизонтов, а также гаметоцитов. Структура этой няшки (BRD3444) такова: 
Как понять, на что действует эта молекула?
Для этого исследователи решили вывести устойчивого к ней плазмодия и посмотреть, как изменился его геном. Зная, мутация каких участков ДНК произошли, можно определить, за синтез каких белков они отвечают. Так и сделали. Оказалось, что новоиспечённая молекула ингибирует фенилаланин-тРНК-синтетазу — фермент, который пришпандоривает аминокислоту фенилаланин к транспортной РНК, чтобы последняя могла наращивать полипептидную цепочку белка. Точности ради отмечу, что при выяснении механизма действия работали не с найденной путём скрининга молекулой, а с её более водорастворимым аналогом, в котором гидроксильная группа заменена на аминогруппу.
Что дальше?
А дальше — это главное.
Как я писал, BRD3444 обладает одним недостатком — она не очень хорошо растворяется в воде. Но это не самый важный её недостаток. BRD3444 очень быстро метаболизируется, что приводит к низкой продолжительности жизни молекулы в организме и требует частого приёма. Таким образом, соединение требовало доработки.
Как понять, какие части молекулы можно трогать без потери молекулы, а какие — нет? И тут очень помогла выбранная стратегия синтеза «строй, соединяй, замыкай». Одной из её особенностей является то, что она направлена на получение стереоизомеров — молекул, отличающихся пространственным расположением атомов в пространстве. Те из вас, кто знаком с основами стереохимии, легко определят, что для BRD3444 возможно существование 8 стереоизомеров. После изучения их биологической активности оказалось, что конфигурация 2 из 3 асимметрических атомов углерода крайне важна для сохранения высокой активности в отношении малярийного плазмодия. Конфигурация третьего асимметрического центра была не столь важна: оба диастереомера, отличающиеся по его конфигурации, были высоко активны. Это навело на мысль, что манипуляции с заместителями как раз у этого атома углерода наименее всего будут сказываться на активности молекулы. Так и оказалось.
Достаточно простые манипуляции позволили получить соединение, которое задерживается в организме мыши гораздо дольше и, кроме того, обладает несколько большей активностью — BRD7929. Этот улучшенный аналог обладал активностью в отношении всех 3 стадий жизненного цикла плазмодия, встречающегося в организмах млекопитающих: эритроцитарных и тканевых шизонтов, а также гаметоцитов. Одной его дозы было достаточно как для профилактики, так и излечения заражённых животных.
Кстати, интересно, как современные технологии позволяют проводить скрининг с минимальными усилиями. Не могу не написать об этом.
Классический метод определения наличия плазмодия — микроскопия мазов крови. Метод достаточно чувствительный и не очень трудоёмкий. Однако, сами понимаете, когда у тебя в опыте сотни грызунов, взятие крови и микроскопия превращаются в тяжёлый труд, да и крови у мелких грызунов, мышей, не всегда особо наберёшься, особенно если надо наблюдать за течением болезни несколько недель. Сейчас за ваш счёт доступно практически любое удовольствие. Например, в описанном мною исследовании паразитемию, т.е. число плазмодиев в крови, определяли с помощью специального прибора по биолюминисценции. Мышку посветили светом, а потом посмотрели, как она сама светится: чем сильнее, тем больше в крови паразитов. Лепота! 
Ну и несколько критических замечаний, чтобы оправдать иронию заголовка моего рассказика.
В опытах по определению мишени для возникновения устойчивости к новому классу соединений малярийному плазмодию понадобилась всего 1 мутация в гене, кодирующем фенилаланин-тРНК-синтетазу. Несмотря на то, что возникновение такой мутации маловероятно, заняло продолжительное время и потребовало постепенного увеличения концентрации терапевтического агента, пройдёт пару годков после того, как препараты этого класса появятся в клинике, — и всей птичке пропасть: мутантный плазмодий продолжит, как ни в чём не бывало, жрать гемоглобин наших с вами эритроцитов.
Возникает несколько вопросов к токсичности открытого класса потенциальных противомалярийных препаратов. Несмотря на то, что отобранное в ходе скрининга соединение BRD3444 не обладало цитотоксичностью, умеренная цитотоксичность присуща его производным. Кроме того, некоторые из этих производных потенциально могут проявлять кардиотоксичность. Странно также, что медицинские химики, которые работали над проектом, в упор не заметили возможности образования опасных хинонимнов… Что-то мне подсказывает, что путь аналогов BRD3444 в клинику будет непростым. Пожелаем им удачи.
Спасибо за внимание.
