Увидеть незримое и почувствовать неосязаемое. На что еще способен электронный микроскоп?
Ни для кого не секрет, что существуют вещи и организмы настолько маленькие, что увидеть их невооруженным глазом просто невозможно. Однако за последние сто лет наука шагнула далеко вперед. И теперь мы можем не только посмотреть на инфузорию, но и увидеть собственными глазами атомы, и даже, буквально, пощупать рельеф микроструктуры кристаллов. А все благодаря электронной микроскопии… Давайте разберемся, как такое возможно.
Перед вами небольшой обзор на электронные микроскопы и их возможности.
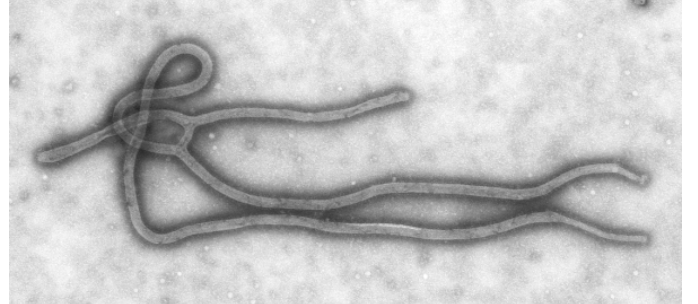
Изображение вируса Эбола, полученное при помощи просвечивающей электронной микроскопии
Несмотря на то, что «электронная микроскопия» звучит очень современно, запатентована она была еще в 1931 году германо-американским инженером и изобретателем Райнхольдом Руденбергом. Это был настоящий переворот в области изучения микроструктур.
▎В чем суть электронной микроскопии?
Как уже было сказано, на исследуемый объект подается пучок электронов, который фокусируется на образце при помощи электромагнитного поля. «Точка» фокусировки электронов имеет не более 5 нм в диаметре. Для сравнения, толщина волоса — 80 000 нм. При соприкосновении с объектом электроны частично проникают внутрь, вытесняя родные электроны и фотоны образца, которые, в свою очередь, попадают на лучевую трубку, где и формируется изображение.
▎Каковы преимущества электронной микроскопии?
- Первое и основное отличие от светового микроскопа — увеличение. Профессиональный современный световой микроскоп может увеличить изображение в 2 тысячи раз. Электронный микроскоп дает увеличение до 300 тысяч при разрешающей способности 0,5 нм. На таком увеличении уже можно рассмотреть атомы.
- Второе существенное преимущество — при помощи спектрального анализа рентгеновского излучения, возбуждаемого электромагнитным полем, можно изучить химический состав образца в конкретных точках.
- В процессе можно воздействовать на исследуемый объект: облучать, нагревать, намагничивать или деформировать. И полученная картинка будет динамически изменяться.
- Имеется возможность зафиксировать процессы на фото- или видеосъемку в высоком разрешении.
- Исследователь получает электронно-оптическую информацию, которую можно дополнить данными, основанными на дифракции электронов с материалом исследуемого объекта. К примеру, определение показателей кристаллографии при использовании дифракционного контраста.
- В растровой разновидности электронной микроскопии можно рассматривать рельеф поверхности объекта при помощи анализа катодолюминесценции.
▎А каковы недостатки?
А вот недостатков много:
- Во-первых, в отличие от светового микроскопа, в котором образец можно просто поместить под окуляр, в ЭМ для работы необходим вакуум. Поэтому исследуемые образцы должны быть хорошо обработаны и зафиксированы. А потому невозможно исследовать живые объекты.
- Во-вторых, необходимо сделать ультратонкий срез исследуемого образца: от 20 до 50 нм, который к тому же должен быть равномерным. Иначе электронный поток поглотится объектом и картинки не будет.
- В-третьих, требуется высокое напряжение — от 50 кВ. А вместе с ним и специальная система охлаждения.
- Из-за повышенной чувствительности и хрупкости ЭМ нужно размещать абсолютно неподвижно, на виброустойчивой колонне, в здании без внешних магнитных полей.
- ЭМ создает исключительно черно-белые изображения.
- И, конечно, стоимость. Далеко не каждый исследовательский центр может позволить себе ЭМ. Он дорог и при покупке, и в обслуживании.
Теперь давайте рассмотрим основные виды электронной микроскопии.
А основных видов два:
- Трансмиссионная или просвечивающая электронная микроскопия (ПЭМ)
- Растровая или сканирующая электронная микроскопия (СЭМ)

Нитчатая водоросоль в световом микроскопе (а), СЭМ (б) и ПЭМ (в)
▎Просвечивающий электронный микроскоп
ПЭМ похож на обычный световой микроскоп, но вместо луча света используется поток электронов, а длина волны намного меньше, чем фотонная. Поэтому изображения получаются в более высоком разрешении.
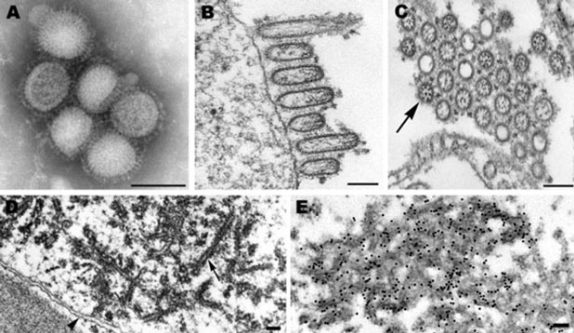
Вирус свиного гриппа в просвечивающим электронном микроскопе
Фокусировка электронного потока осуществляется при помощи электромагнитных и электростатических линз. Возникают даже присущие фотонным микроскопам хроматические аберрации. Только природа такого искажения абсолютно иная. Кроме того, за счет закручивания электронов вдоль оси пучка в линзе, возникают дополнительные искажения.
Из недостатков: объект, помещаемый в ПЭМ, должен быть не толще 1 микрона, то есть как один слой волоса, разрезанного вдоль на 50 частей. А вторая проблема — размер. ПЭМ занимает целую комнату: высотой в человеческий рост и с блоком питания, размером со шкаф.
ㅤㅤㅤПросвечивающий электронный микроскоп
▎Сканирующий электронный микроскоп
СЭМ позволяет получать изображение очень высокого разрешения. Узко сфокусированный луч электронов микрон за микроном сканирует поверхность изучаемого образца. СЭМ дает возможность, в том числе, получить трехмерное изображение. У данного типа микроскопов имеется большое количество датчиков, способных улавливать все вытесняемые электронами частицы: электроны, видимый инфракрасный и ультрафиолетовый спектры света, рентгеновское излучение.
ㅤㅤСканирующий электронный микроскоп
У СЭМ есть несколько принципиально разных режимов работы, которые зависят от детекторов.
Рассмотрим основные виды:
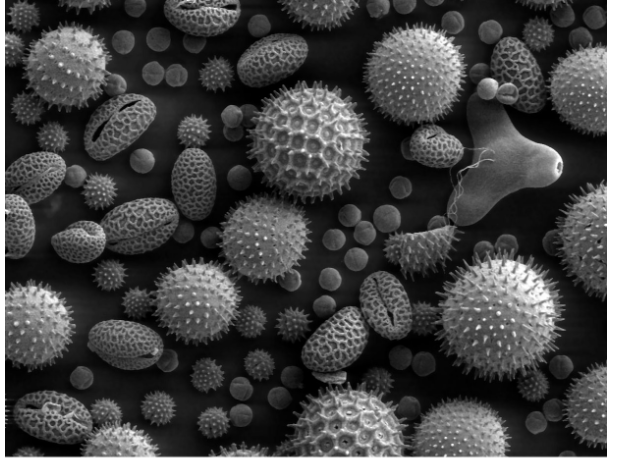
Изображение пыльцы, полученное путем детектирования вторичных электронов
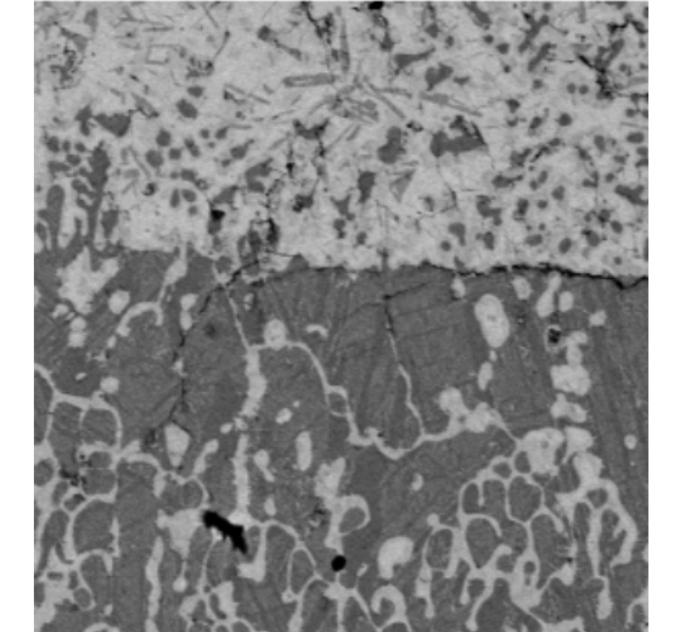
Морфология интерфейса между оксидной и металлической составляющими, сделанная в режиме детектирования отраженных электронов

Анализ элементного состава микрокомпонентов полированного образца анодного шлака с помощью энергодиспрсионного спектрометра
Коррозия, распространяющаяся сквозь хромовое покрытие на стали. Изображение получено при помощи детектирования прошедших электронов.

Изображение циркона, полученное
при детектировании катодолюминесцентного излучения
СЭМ может работать исключительно с твердыми образцами в вакууме. Поэтому для работы с жидкостями, их необходимо подвергнуть глубокой заморозке. Зато форма и размер образца могут быть любыми в пределах объема рабочей камеры. Продуктивность работы повышается при нанесении на исследуемый образец тонкого слоя токопроводящего материала.
Электронная микроскопия применяется во многих сферах науки и промышленности:
При помощи ЭМ можно осуществить томографию тканей, детально рассмотреть клетки, определить локализацию белков, увидеть вирус и даже выполнить фармацевтический контроль качества.
ЭМ позволяет изучить микроструктуры металлов и кристаллов вещества, классифицировать материалы, тестировать характеристики различных веществ, определять состав, поверхность и плотность объектов.
С помощью ЭМ выявляются и редактируются неисправности систем, выполняется анализ дефектов.
ЭМ помогает определять параметры частиц и целых структур. Позволяет в динамике посмотреть на материалы в высоком разрешении. При необходимости дает возможность построения трехмерной модели микроструктуры.
▎3D моделирование
В некоторых случаях, к примеру, в биологии и медицине, могут потребоваться не просто фотографии ультратонких срезов, а трехмерные изображения какой-либо ткани или организма.
Это возможно осуществить несколькими способами:
Самый первый из подходов к трехмерному моделированию на электронном микроскопе. Способ заключается в создании ленты ультратонких срезов, которые собираются на специальной сетке, покрываемой углеродом и особым веществом — формваром. Полученные изображения обрабатываются в специальной программе: создается контур, фотографии выравниваются, обрезаются и сводятся в одно трехмерное изображение. Процесс сведения трудоемкий и занимает очень много времени, а размеры изображения ограничены. Еще одной проблемой являются существенные зазоры между слоями. Кроме того, ультратонкие срезы очень хрупкие и подвержены повреждениям. И чем их больше, тем выше шанс деформации образца.
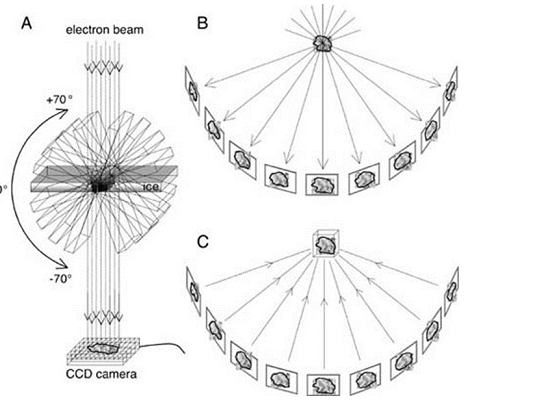
Принцип метода криоэлектронной томографии
В процессе КЭТ объект исследования постепенно поворачивается и изображения получаются под разным углом наклона. После этого все фотографии сводятся в одно 3D изображение. Минус метода в том, что образец получает высокую дозу излучения, за счет чего часть мелких деталей теряется в процессе исследования.

Раскрашенное изображение бактериофагов
(зеленые), поразивших кишечную палочку (голубые), сделанное в ФИЛ-СЭМ
Сложность метода в подготовке. Перед проведением операции необходимо защитить образец от части заряда. Для этого на сам объект, к примеру, кусок органа, напыляется металл, а блок, в который заключен образец, покрывается серебряной пастой. Максимальный размер моделируемого объекта — 100×100 мкм. Кроме того, метод очень долгий, а с увеличением глубины резки снижается качество.
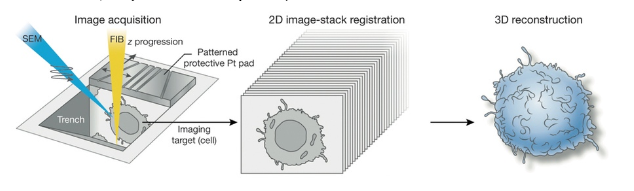
Принцип метода ФИЛ-СЭМ

Ультрамикротом со специальной насадкой и вставленной лентой для срезов
Используется для получения трехмерной модели большого объекта. Для этого ультрамикротом помещается внутрь СЭМ. В процессе происходит последовательное срезание ультратонких слоев образца с последующим сканированием. Для улучшения изображения может использоваться контраст. Преимущество данного метода заключается в величине объекта и скорости обработки информации. За получаемыми данными можно наблюдать в реальном времени.
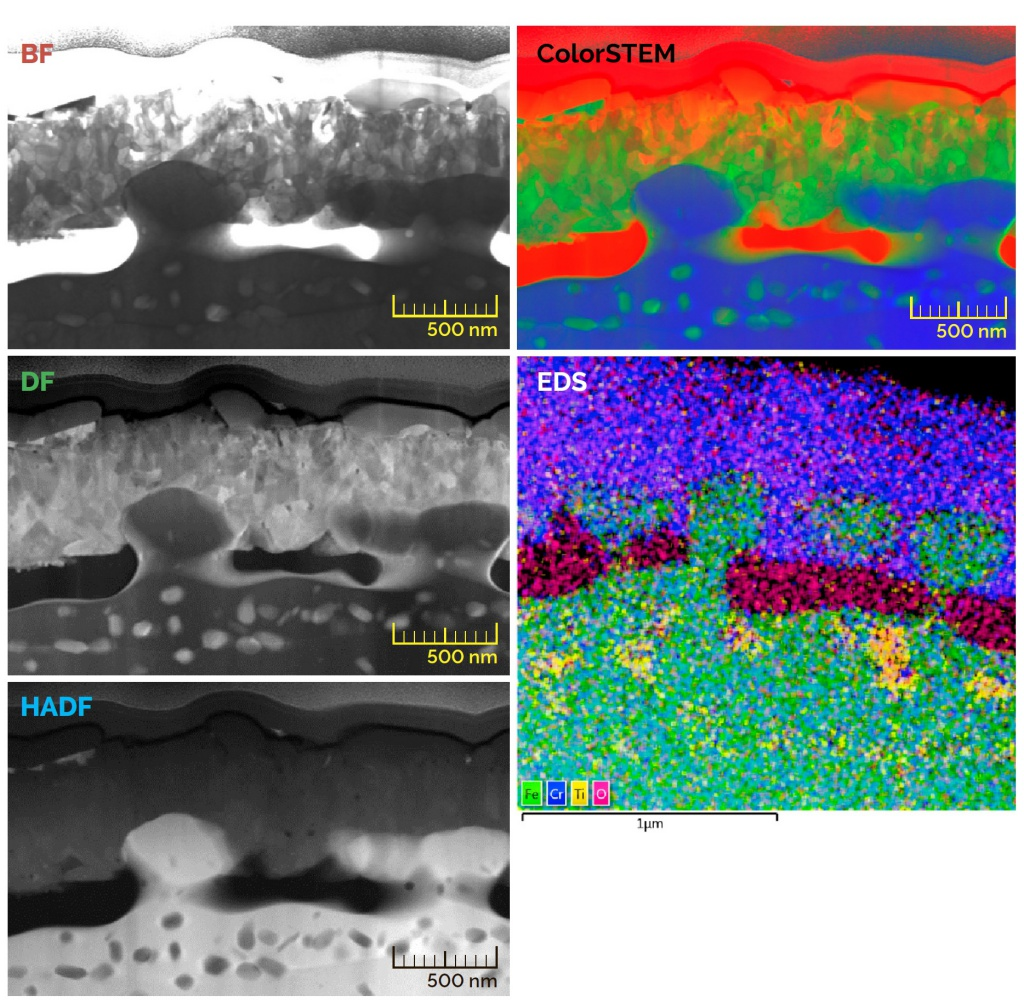
▎Цветное изображение
Большим минусом ЭМ является черно-белое изображение. Однако и с этим ученые смогли справиться.
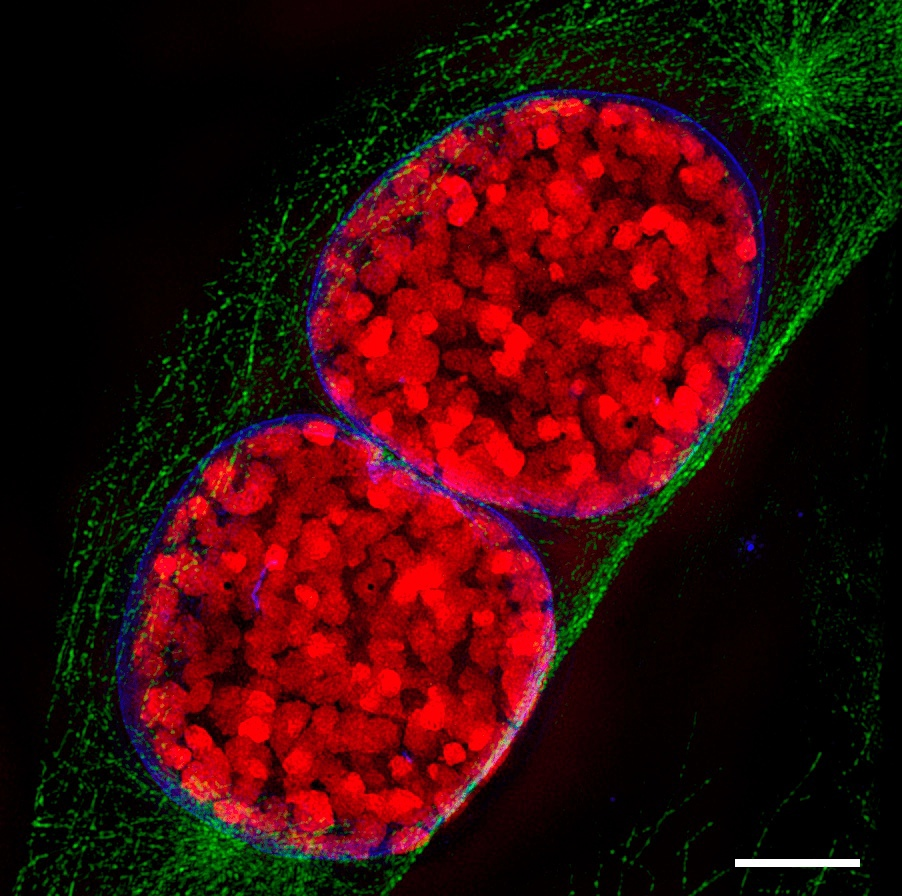
Коррелятивная свето-электронная микроскопия элементов цитоскелета
Ученые объединили КСЭМ с трехмерной световой микроскопией, уже известной нам ФИЛ-СЭМ и с микроскопией сверхвысокого разрешения (СР-микроскопия), которая позволяет получить большее разрешение за счет объединения на экране множества снимков.
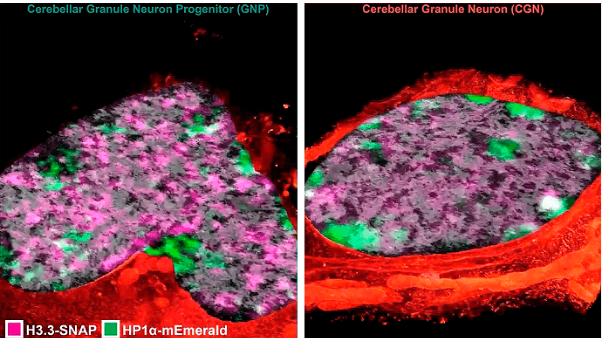
Срез ядер нейронов при микроскопии сверхвысокого разрешения
Составив изначально изображение высокого разрешения, ученые резали образец лучами ионов. Изображение получало цвет за счет световой микроскопии структурированного освещения, позволяющего увеличить разрешение снимка в два раза за счет поочередной подсветки отдельных точек при фоновом свечении остального образца, и одномолекулярной световой микроскопии, при которой флуоресценция красителя активируется слабым лазером. Одномолекулярная микроскопия позволяет получить изображение с разрешением 0,2 мкм. Все полученные изображения свели вместе и получили полноценные цветные снимки. С помощью данной методики удалось разглядеть, к примеру, ультраструктуру нейронов.
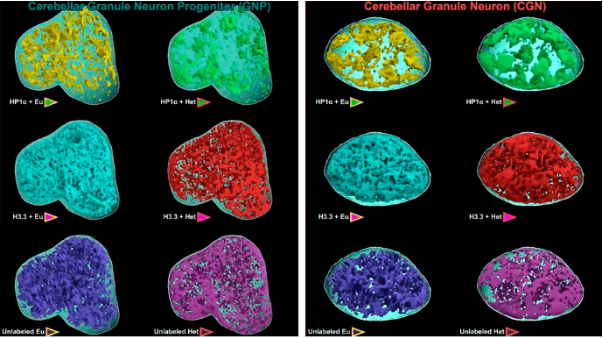
Трехмерные модели ядер нейронов, полученные при коррелятивной микроскопии
Итак, электронный микроскоп — вещь, во многих сферах незаменимая. Ученые потихоньку нивелируют его минусы и решают проблемы, связанные с его использованием. Возможно, в скором времени, из минусов останутся только размер и стоимость. Хотя… Может, и это исправимо?
- Гоулдстейн Дж., Ньюбери Д., Эчлин П., Джой Д., Фиори Ч., Лифшин Ф. Растровая электронная микроскопия и рентгеновский микроанализ: в двух книгах. Пер. с англ. — М.: Мир, 1984. 303 с.
- Уманский Я. С., Скаков Ю. А., Иванов А. Н., Расторгуев Л. Н… Кристаллография, рентгенография и электронная микроскопия. — М.: Металлургия, 1982, 632 с.
- СиндоД. Оикава. Т. Аналитическая просвечивающая электронная микроскопия. — М.: Техносфера, 2006, 256 с. ISBN 5–94836–064–4.
- Denk, W., & Horstmann, H. (2004). Serial block-face scanning electron microscopy to reconstruct three-dimensional tissue nanostructure. PLoS Biology, 2(11).
- Efimov, A. E., Tonevitsky, A. G., Dittrich, M., & Matsko, N. B. (2007). Atomic force microscope (AFM) combined with the ultramicrotome: A novel device for the serial section tomography and AFM/TEM complementary structural analysis of biological and polymer samples. Journal of Microscopy, 226(3), 207–217. doi.org/10.1111/j.1365–2818.2007.01773.x
- Schalek, R., Kasthuri, N., Hayworth, K., Berger, D., Tapia, J., Morgan, J., … Lichtman, J. (2011). Development of High-Throughput, High-Resolution 3D Reconstruction of Large-Volume Biological Tissue Using Automated Tape Collection Ultramicrotomy and Scanning Electron Microscopy. Microscopy and Microanalysis, 17(S2), 966–967. doi.org/10.1017/S1431927611005708
- Wagner, J., Schaffer, M., & Fernández-Busnadiego, R. (2017, September 1). Cryo-electron tomography—the cell biology that came in from the cold. FEBS Letters. Wiley Blackwell. doi.org/10.1002/1873–3468.12757
