Тяжёлыми частицами по опухолям: как работает лучевая терапия?
Мирный атом, как мы уже писали, — это не только Чернобыль и Фукусима. При грамотном и осторожном использовании он способен принести человечеству неоценимую пользу, — например, когда речь идёт о прорывных технологиях в области энергетики. Но не только: сегодня поговорим о лучевой терапии для лечения рака.
Согласно данным из исследования Global Burden of Disease Cancer Collaboration, которое опубликовала международная команда ученых из 195 стран осенью 2019 года, с 2007 по 2017 год число случаев онкологических заболеваний в мире выросло на треть. В 2017 году раком заболели 24,5 миллиона человек, 9,6 миллиона от него скончались. А самым динамично развивающимся способом лечения онкологических заболеваний стала лучевая терапия. По эффективности она не отстает от других методов и при этом щадяще относится к организму пациента.
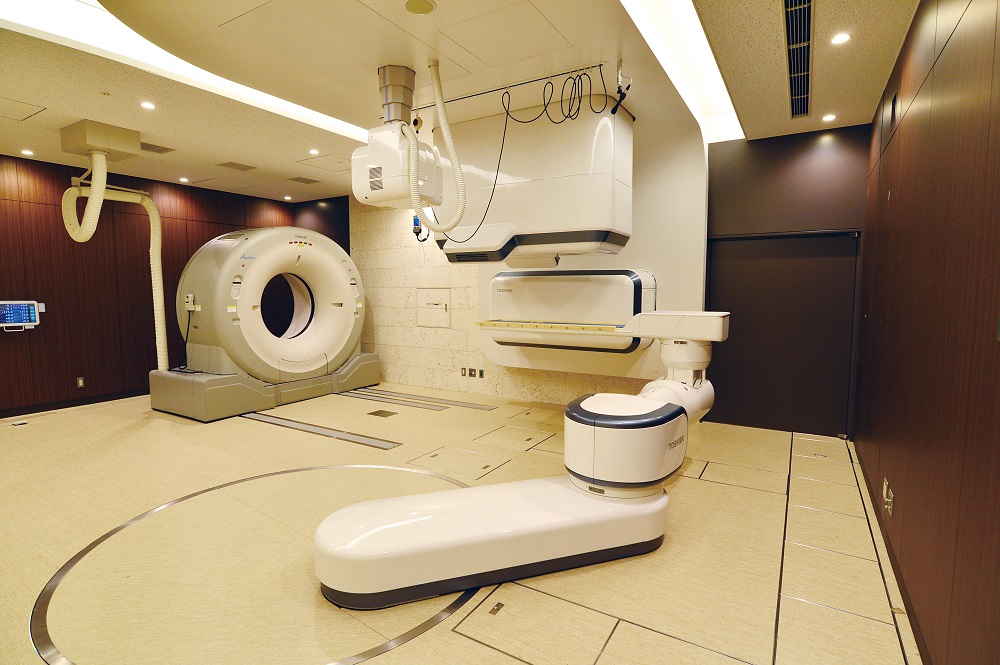
Комната, где проводится лучевая терапия (здесь — с помощью аппарата i-ROCK), сегодня может выглядеть не как больничная палата, а, скорее, как помещение космического корабля из далёкого будущего. Источник: Toshiba
Как лечат рак?
Предотвращают деление клеток опухоли и её разрастание и распространение заболевания по организму, а также провоцируют её гибель. Вообще, опухоль можно удалить, вырезав из поражённого органа или вместе с ним, или отравить, постаравшись сделать так, чтобы одновременно не отравился весь остальной организм. Последнее, к счастью, возможно сделать в силу особенности раковых клеток. Но химиотерапия, а уж тем более удаление органа или его части, зачастую воздействует на организм весьма губительно. Поэтому учёные работают над альтернативными методами с научно доказанной эффективностью. Один из них — как раз лучевая терапия.
Лучевая терапия (или радиотерапия) — это использование радиации для борьбы со злокачественными опухолями. При помощи излучения, которое направляется непосредственно на поражённые опухолью ткани и воздействует на её клетки на генетическом уровне, их удаётся полностью уничтожить или как минимум сдержать их рост и деление. Несмотря на то, что сами эти слова звучат довольно страшно — целенаправленно облучать радиацией живого человека! — этот способ доказал свою эффективность и безопасность.
Действие лучевой терапии тоже основано на особенностях опухолевых клеток: как выяснили учёные, тот факт, что такая клетка делится быстрее обычных, приводит к тому, что на неё большее влияние оказывает радиация. С одной стороны, быстрое деление позволяет им с высокой скоростью распространяться в организме, с другой — даёт возможность ввести своеобразную систему распознавания «свой — чужой» и воздействовать радиацией исключительно на них. В результате облучения деление клеток опухоли замедляется и/или прекращается, они распадаются и постепенно выводятся из организма.
При воздействии радиации на клетку первая задача — повредить её ДНК. В результате этого клетка инактивируется, то есть потеряет возможность делиться, и в итоге это приведёт к её гибели. При этом молекула ДНК полностью разрушается у опухолевых клеток и частично, не теряя при этом возможности к восстановлению, — у здоровых. Современные технологии при этом позволяют минимизировать воздействие облучения на здоровые клетки. Как этого удаётся добиться, расскажем чуть ниже.
По сравнению с хирургическим вмешательством и химиотерапией, лучевая терапия обладает рядом преимуществ. Так, если химиотерапия оказывает влияние на организм пациента в целом, что может значительно его ослабить и дать неприятные негативные последствия, то лучевая терапия направлена исключительно на опухоль и в норме оказывает лишь минимальное влияние на соседние здоровые клетки. Конечно, в случае возникновения системного рака, который успел охватить несколько органов, химиотерапия может работать более эффективно.
Если сравнивать лучевую терапию с хирургическим вмешательством, то и здесь у первой есть несомненное достоинство: она не требует проведения операции, которую в некоторых случаях пациенту будет сложно перенести, в особенности если его организм уже значительно ослаблен болезнью и последующим её лечением. Кроме того, чисто хирургическим способом бывает не так просто добраться до некоторых опухолей, и возникает риск повреждения соседних органов.
Лучевая терапия позволяет достичь того же результата — полного исчезновения опухоли — без необходимости ложиться под нож. Лучше всего этот метод лечения работает при избавлении от не успевших распространиться по организму новообразований в отдельных органах, например, в мозге, лёгком, желудке, простате и так далее.
В современной онкологии лучевая терапия может использоваться как отдельно сама по себе, так и в сочетании с другими методами лечения — хирургическим и химиотерапией. В частности, распространена схема лечения, когда используются одновременно хирургическое вмешательство и облучение.
В этом случае могут быть такие виды лучевой терапии: неоадъювантная (до операции) и адъювантная (после операции). Неоадъювантное облучение помогает уменьшить размеры опухоли, чтобы довести её до операбельного состояния и снизить риск возникновения метастазов, а адъюватная используется для борьбы с местными рецидивами опухоли.
Как радиация попадает в организм и какой может нанести вред?
Облучение исключительно вредных клеток — филигранная работа. Самый главный вопрос, который возникает перед врачом, можно сформулировать так: каким образом можно доставить частицы в нужное место и не облучить при этом случайно ничего лишнего?
Есть три метода осуществления лучевой терапии: дистанционный, контактный и системный.
Системная лучевая терапия подразумевает, что в организм пациента вводятся радиоактивные лекарственные препараты (проглатыванием или внутривенно). Они распределятся по кровотоку и воздействуют на опухолевые очаги. Так, к примеру, при помощи капсул, которые содержат радиоактивный йод, лечат некоторые виды рака щитовидной железы.
При использовании контактной лучевой терапии (она же — брахитерапия) источники излучения размещаются или внутри повреждённого органа, или в полости рядом с ним. В отдельных случаях излучатели можно размещать даже на поверхности кожи.
Наиболее распространённым стал дистанционный метод, когда используется внешний источник излучения, а между ним и мишенью могут лежать здоровые ткани. Последние получают минимальный урон, так как практически вся радиационная доза выделяется в опухоли на последних миллиметрах пробега частиц. Чтобы этого добиться, изначально использовали особые приборы, представлявшие собой, говоря по-простому, контейнер с радиоактивным веществом и механизм, позволяющий формировать узкий пучок излучения.
Одним из пионеров этого метода лечения стал канадский медицинский физик Гарольд Элфорд Джонс (Harold Elford Johns) — группа учёных под его руководством в начале 1950-х создала так называемую «кобальтовую пушку», в которой использовался радиоактивный кобальт-60.
А первый специальный медицинский ускоритель частиц собрали и применили в Лондоне (Великобритания) в 1953-м году. Зачем? Чтобы добиться больших проникновения и эффективности излучения и достать глубоко расположенные опухоли. И именно в направлении развития радиотерапии с использованием линейных ускорителей частиц двигался и движется прогресс в последние полвека.

Гордон Айзекс, первый пациент, излечившийся в 1957 году от ретинобластомы (злокачественная опухоль сетчатки глаза у детей) с помощью линейного ускорителя, построенного и применённого американским учёным Генри Капланом. В результате лечения зрение мальчика удалось спасти, а сам он прожил долгую жизнь. Источник: Wikimedia Commons
Лучевая терапия может быть волновой или корпускулярной. Волновое излучение, при котором на клетки опухоли направлялись рентгеновские или гамма-лучи, стали использовать в медицине раньше (в частности, именно гамма-излучение производила кобальтовая пушка Джонса), и со своими задачами оно в целом справлялось, хотя при волновом облучении радиацию невозможно направить чётко на повреждённые клетки.
Сегодня более эффективным считается корпускулярное облучение. В этом случае на опухоль направляются пучки элементарных частиц: фотонов, нейтронов или тяжёлых ионов. И именно облучение тяжёлыми ионами на данный момент считается самым технологически продвинутым методом радиотерапии, поскольку благодаря своей массе (не зря они называются тяжёлыми) они формируют своеобразную ударную волну и поэтому более эффективно разрушают ДНК раковых клеток — для успешного избавления от опухоли с использованием тяжёлых ионов требуется меньше сеансов облучения.
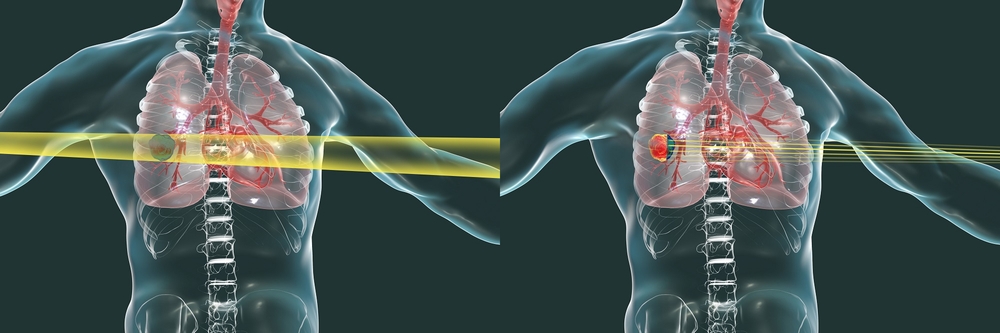
Рентгеновские лучи (слева) и лучи тяжёлых ионов (справа). Тяжёлые ионы направляются чётко на опухоль, сводя к минимуму повреждение здоровых тканей. Источник: Toshiba
Что касается других частиц, то они обладают меньшей способностью проникать в ткани. Поэтому самые лёгкие из них — электроны — используются лишь для лечения кожных заболеваний. Более тяжёлые — фотоны — проникают глубже, но всё же не обладают такой ударной силой, как тяжёлые ионы. Фотонами тоже лечат опухоли во внутренних органах, но при большем количестве сеансов облучения.
Безвредна ли лучевая терапия? Нет. Несмотря на очевидные преимущества, как и любое интенсивное лечение, лучевая терапия редко проходит для организма абсолютно бесследно. Последствиями её применения могут стать локальные лучевые ожоги, а сосуды, которые находятся в непосредственной близости к опухоли, могут стать более ломкими. Это приводит к риску появления мелкоочаговых кровоизлияний.
Существует вероятность и возникновения долгосрочных побочных эффектов в результате попадания продуктов распада опухоли в кровь. Тем не менее, они всё же не смертельно опасны — в отличие от злокачественных опухолей. По мнению специалистов, эффект от применения лучевой терапии можно сравнить с солнечным ожогом: его последствия не всегда видны сразу, но могут проявиться со временем. Таким образом, существует ненулевая вероятность, что спустя 10–20 лет у пациента могут начаться изменения на уровне ДНК или же рак вернётся.
Как выглядят самые современные установки для проведения лучевой терапии, или Что сделать, чтобы лечить больше и лучше?
Уже от три больницы в Японии заказали у Toshiba установки проведения лучевой терапии тяжёлыми ионами, и компания поставила оборудование заказчикам. А ускоритель тяжёлых ионов i-ROCK успешно работает в Онкологическом центре префектуры Канагава (Kanagawa Cancer Center). На их примере можно видеть, по каким направлениям сегодня идёт эволюция методов лучевой терапии.

Вот так выглядит собственно ускоритель тяжёлых ионов от Toshiba Energy Systems & Solutions в Центре радиационной онкологии в Канагаве (i-ROCK). В ближайшее время аналогичная система появится и в России: уже подписано соответствующее соглашение между Минздравом РФ и японской корпорацией. Источник: Toshiba
i-ROCK — это впечатляющее устройство, которое занимает несколько комнат, суммарная площадь которых сравнима с площадью спортзала. В нём при помощи линейного ускорителя частиц пучок тяжёлых ионов разгоняется до 70% скорости света, прежде чем начать атаковать опухоль. Количество энергии, которая при этом передаётся в раковые клетки, значительно превышает объём энергии рентгеновского излучения или энергии протонов.
Тяжёлые ионы поступают сразу с двух направлений, что повышает эффективность лечения, то есть позволяет добиться умерщвления опухоли за меньшее количество сеансов. Притом излучатели могут вращаться на 360 градусов, за счёт чего достигается высокая точность воздействия.
Современные установки, включая i-ROCK, научились минимизировать поражение здоровых тканей во время облучения. Для этого нужно было сделать так, чтобы пучок частиц был тонким и сила излучения достаточной для поражения опухоли, но не тканей вокруг. В i-ROCK применяется метод 3D-сканирования опухоли, благодаря которому удаётся атаковать исключительно её саму, какой бы сложной формы она ни была, с высокой точностью. Это называется облучение высокоскоростным сканирующим лучом (High Speed Scanning Beam Irradiation).
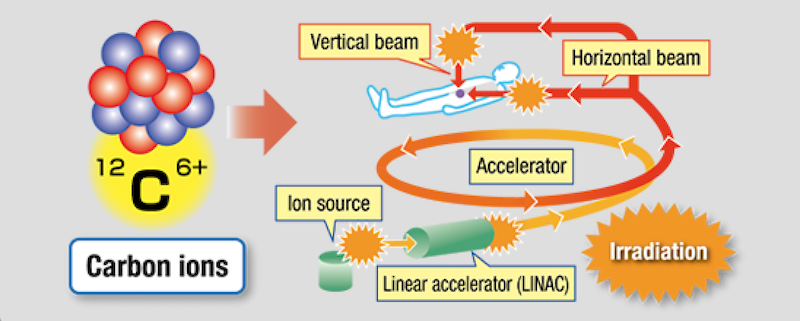
Берём ионы углерода, сильно разгоняем в линейном ускорителе и направляем в тело пациента, но не абы куда, а ровно в цель. Источник: Toshiba
При использовании разработанного Toshiba метода 3D-сканирование в ходе терапии тяжёлыми ионами, облучение опухоли происходит так, будто её заштриховывают тонким карандашом. Этот метод позволяет воздействовать на опухоли сложной формы и действовать высокоточно и эффективно. Ещё одно следствие применения такого метода — можно исключить этап длительной настройки оборудования и применение коллиматоров и фильтров, которые должны изготавливаться индивидуально для каждого пациента.
А что делать с органами, которые в норме движутся, до тех пор, пока их владелец жив, — например, с лёгкими? На вдохе опухоль в лёгком будет в одном положении, на выдохе же на её месте под лучом окажутся здоровые ткани. Чтобы этого избежать, инженеры Toshiba добавили к установке инструмент для наблюдения за телом пациента в реальном времени, позволяющий включать излучение, когда орган находится в фокусе излучателя, и отключать, когда он перемещается. Соединив облучение с синхронизацией по дыханию и наблюдение за зоной облучения с помощью рентгенограммы в косой проекции в реальном времени с технологией повторного сканирования, инженеры Toshiba научились выполнять быстрое и аккуратное облучение новообразований равномерными дозами не только на неподвижных, но и на движущихся органах.
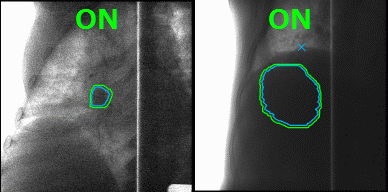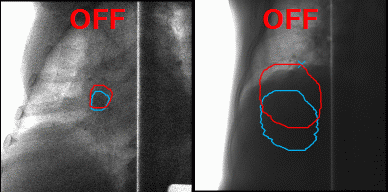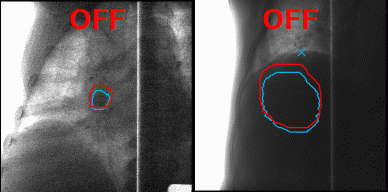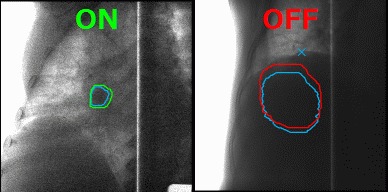
Благодаря наблюдению за внутренностями пациента в реальном времени минимизируется поражение здоровых тканей в ходе радиотерапии. Источник: Toshiba
Помимо всего прочего, такого сочетание технологий и методов, с одной стороны, позволяет снизить сроки подготовки к лечению и его стоимость для пациента, а с другой — увеличить количество пациентов, которые госпиталь может принять в отчётный период, а следовательно, ускорить окупаемость оборудования. Toshiba помогла уменьшить время, необходимое для размещения пациента, создав эффективную систему позиционирования, а общее время пребывания в помещении для проведения терапии значительно сокращается при применении высокоскоростного 3D-сканирующего облучения. Система позиционирования Toshiba автоматически рассчитывает расхождение между компьютерной томограммой зоны облучения, полученной при планировании терапии, и рентгеновским снимком, сделанным непосредственно в помещении, где ведётся облучение, и подстраивает положение роботизированной койки, на которой располагается пациент. Если при использовании аппаратов для лучевой терапии предыдущего поколения средняя продолжительность сеанса от входа пациента в комнату до его выхода составляла 26 минут, то теперь его удалось снизить до 11 минут.
Наконец, ещё одно направление работы инженеров — снижение массы и размеров всего комплекса оборудования, что в свою очередь в конечном итоге опять-таки повышает доступность лечения для каждого пациента. Тут Toshiba тоже есть чем гордиться: она создала самый компактный в мире (по состоянию на 1 октября 2017 года) вращающийся гантри (так называют подвижное устройство, используемое для удерживания и нацеливания медицинского оборудования на зафиксированного пациента), используемый при терапии тяжёлыми ионами. Этого удалось достичь за счёт применения сверхпроводниковых технологий. Если гантри может вращаться на 360 градусов вокруг пациента, это позволяет точно прицеливаться в опухоль с любого направления, уменьшить или исключить поражение здоровых тканей, быстрее разместить пациента нужным образом и уменьшить его дискомфорт, а заодно и максимально исключить деформацию органов; более того, впоследствии, при следующих сеансах облучения, положение пациента можно быстро воспроизвести.
Учёные Национальных институтов квантовых и радиологических исследований и технологий (National Institutes for Quantum and Radiological Science and Technology — QST; японская научно-исследовательская организация, созданная в 2016 году путём слияния Национального института радиологических исследований и нескольких подразделений Японского агентства по атомной энергии), в июне 2019 года создали компактный ротационный гантри с использованием сверхпроводящего магнита, что позволило уменьшить вес оборудования примерно на 300 тонн. Меньший по размерам и весу гантри можно будет более удобно разместить его в здании больницы, и это снизит издержки на строительные работы, содержание и обслуживание, а значит, снизит и стоимость лечения.
Наконец, стоит рассказать и о том, как обеспечивается безопасность лечения. Во-первых, ускоритель и пациент находятся в разных помещениях. Последний располагается в отдельной совсем не страшно выглядящей комнате (показана в начале поста) на койке, которую можно перемещать по семи осям, чтобы обеспечить облучение любого органа и при этом сохранить удобное для пациента положение. Оптимальное положение койки и излучателей, как мы уже упомянули, определяется на основе предварительно сделанной компьютерной томограммы и рентгеновского сканирования в реальном времени уже непосредственно перед началом процедуры.
Медицинский работник может наблюдать за лечением, используя систему мониторинга луча, разработанную Toshiba: пока продолжается облучение, положение луча и плотность потока на каждом участке облучаемых тканей выводится на экране монитора в аппаратной в реальном времени. Состояние оборудования также постоянно проверяется — это позволяет гарантировать безопасность пациента. Если что-то пойдёт не так, специальная система блокировки остановит поток частиц. Интерфейс управления оборудованием был специально разработан так, чтоб минимизировать возможность ошибки, вызванной человеческим фактором, и дать медицинским работникам чувство уверенности и безопасности.
Разорительна ли лучевая терапия?
Как и любая новая технология, в разработку которой было вложено много средств и усилий высококвалифицированных специалистов, лучевая терапия не может быть дешёвой. Для пациента курс лечения обойдётся в среднем дороже, чем курс химиотерапии (точные расчёты зависят от тяжести каждого конкретного случая).
Высокая стоимость объяснима: во-первых, больницам необходимо вложиться в покупку дорогого оборудования. Во-вторых, его техническое обслуживание потребует дополнительных расходов. В-третьих, для работы на нём нужен персонал с высоким уровнем квалификации — на его обучение и содержание также придётся потратиться.
Что касается стоимости самого оборудования, то здесь рамки очень широкие. Так, простейший, не самый новый, и, возможно, бывший в употреблении линейный ускоритель за рубежом может стоить до $300 тысяч. Цена более новых систем вырастает до миллиона долларов и выше. При этом новейшие разработки могут оцениваться уже в несколько миллионов долларов США. В целом же на полноценное оборудование клиники радиотерапии в США, к примеру, придётся потратить от $20 миллионов до $150 миллионов, а в некоторых случаях даже больше. Это зависит от количества мест и других факторов.
Тем не менее, любая эффективная технология со временем проходит один и тот же путь: становится массовой, и как следствие — более доступной. А мы надеемся, что «страшный и опасный» атом уже в ближайшем будущем очистит свой имидж и превратится в спасителя человечества от одной из самых страшных его проблем.
