Омоложение клеток человека за счет их перепрограммирования

Говорят, что жизнь это один сплошной процесс старения, который неминуемо заканчивается смертью. Это может звучать не очень оптимистично, но таковы законы природы. Старение и смерть являются одними из важнейших регуляторов популяции какого-либо вида на планете, а бессмертие в биологическом смысле этого слова существует только в книгах и кино. Та же ситуация обстоит и с «вечной» молодостью. В книгах у нас есть Дориан Грей — вечно молодой и красивый юноша с сильнейшей антипатией к определенному произведению изобразительного искусства; Эдвард Каллен — вечно молодой вампир с дефицитом витамина D и повышенной отражательной способностью кожи и т.д. В реальности же вечная или хотя бы продленная молодость недостижима. По крайней мере, если в процесс не вмешиваются ученые. Сегодня мы с вами познакомимся с исследованием, в котором ученые из Стэнфордского университета смогли достичь омоложения старых клеток человека за счет определенных белков, участвующих в процессе эмбрионального развития. Какие именно вещества использовались, насколько помолодели старые клетки и насколько продолжительным был эффект? Об этом мы узнаем из доклада исследовательской группы. Поехали.
Основа исследования
Что есть старение? По своей сути это процесс постепенной утраты функциональности на уровне молекул, клеток, тканей и всего организма.
На уровне хроматина* старение ассоциируется с прогрессирующим накоплением эпигенетических* ошибок, которые в конечном итоге приводят к аберрантной (ненормальной) регуляции генов, истощению стволовых клеток, старению и нарушению гомеостаза клеток / тканей.
Хроматин* — основа хромосом, состоящая из ДНК и белков (по большей степени из гистонов). Расположен хроматин внутри ядра клеток эукариот (организмы, у которых в клетках есть ядро) и входит в состав нуклеоида у прокариот (одноклеточные без ядра).
Эпигенетическое наследование* — совокупность наследуемых изменений в фенотипе или экспрессии генов.
Если же применить ядерное перепрограммирование плюрипотентности* клетки, можно обернуть вспять как ее возраст, но не идентичность.
Плюрипотентность* — характеристика клетки, которая может дифференцироваться во все типы клеток, кроме клеток внезародышевых органов.
Ранее эта методика уже тестировалась на мышах. Результаты были весьма воодушевляющими, так как временное перепрограммирование позволило улучшить возрастные признаки и продлить продолжительность жизни у мышей. Но человек это не мышь, и потому остается вопрос, как данная методика будет работать на клетках человека. Именно это и рассматривают ученые в данном исследовании.
Процесс ядерного перепрограммирования в индуцированные плюрипотентные стволовые клетки (ИПСК*) характеризуется полным сбросом (перезагрузкой) эпигенетических особенностей клеток, что приводит к возвращению как клеточной идентичности, так и возраста в эмбрионоподобное состояние.
Индуцированные плюрипотентные стволовые клетки (ИПСК)* — тип стволовых клеток, полученных в лаборатории из зрелых дифференцированных клеток организма млекопитающего (в том числе и человека).
Любопытно, что перепрограммирование не является необратимым, останавливаясь до так называемой точки невозврата (PNR от point of no return), после чего клетки со временем возвращаются в исходное соматическое* состояние.
Соматическая клетка* — клетки, составляющие сому (тело организма), но не участвующие в половом развитии.
Следовательно, если перепрограммирование будет воздействовать на клетку достаточно короткий промежуток времени, то экспрессия факторов перепрограммирования не сможет стереть эпигенетическую сигнатуру, определяющую идентичность клеток. Получается, что недолгое воздействие не изменит идентичность клетки, но может ли оно воздействовать на ее возраст?
Первое доказательство того, что временное перепрограммирование может способствовать улучшению фенотипов во время старения, было показано на мышах. Но, как ученые нам уже напоминали, мыши — не люди. Важный вопрос данной методики заключается в том, сможет ли она работать на клетках человека естественного возраста, выделенных из пожилых людей.
Чтобы выяснить это, ученые провели ряд экспериментов по выявлению степени воздействия ядерного перепрограммирования на фенотипы (внешние и внутренние признаки) клеток человека и мыши.
Результаты исследования
Сначала была проведена оценка влияние временной экспрессии факторов перепрограммирования на транскриптом двух разных типов клеток (фибробластов* и эндотелиальных* клеток) у пожилых людей. Далее транскриптом пожилых людей сравнили с транскриптомом тех же типов клеток молодых доноров (1a и 1е).
Фибробласт* — клетки соединительной ткани организма, синтезирующие внеклеточный матрикс.
Эндотелий* — слой плоских клеток на внутренних стенках кровеносных сосудов, лимфатических сосудов и сердечных полостей.

Изображение №1
Фибробласты были получены из биоптатов* кожи рук и живота участников исследования: 3 человека в возрасте 25–35 лет (группа молодых) и 8 человек в возрасте 60–90 лет (группа пожилых).
Биоптат* — биологический материал, полученный путем биопсии.
Эндотелиальные клетки были извлечены из подвздошной вены и артерии участников исследования: 3 человека в возрасте 15–25 лет (группа молодых) и 8 человек в возрасте 50–65 лет (группа пожилых).
Для опытов был использован неинтегративный протокол перепрограммирования, который был оптимизирован на основе набора мРНК, экспрессирующих белки OCT4, SOX2, KLF4, c-MYC, LIN28 и NANOG.
Данный протокол последовательно производит колонии ИПСК, независимо от возраста доноров, после 12–15 ежедневных трансфекций*.
Трансфекция* — процесс введения нуклеиновой кислоты в клетки эукариот невирусным методом.
Было установлено, что точка невозврата в данном случае наблюдается на пятый день перепрограммирования. Данный вывод основан на факте того, что первая обнаруживаемая экспрессия эндогенных связанных с плюрипотентностью днкРНК* происходит на 58-й день.
днкРНК (длинные некодирующие РНК)* — расположенные в ядре или в цитоплазме молекулы РНК, которые не транслируются в белки.
Ввиду этого было решено использовать временный режим экзогенной экспрессии, при котором OSKMLN ежедневно трансфицировали в течение 4 дней подряд, и проводили анализ экспрессии гена через 2 дня после прерывания (1b).
Далее было проведено парное массовое РНК-секвенирование для обоих типов клеток всех трех групп испытуемых: молодые (Y), пожилые без перепрограммирования (UA) и пожилые с перепрограммированием (TA).
Для начала ученые сравнили квантильные нормализованные транскриптомы молодых испытуемых и пожилых без перепрограммирования (Y и UA). Анализ показал, что 961 генов (5.85%) в фибробластах (1a и 1c) и 748 генов (4.80%) в эндотелиальных клетках (1e и 1f) различались между молодыми и пожилыми клетками.
Данные наборы генов напрямую связаны с процессами старения. Определение направленности экспрессии выше или ниже среднего значения каждого гена показало явное сходство между клетками молодых людей и клетками пожилых после перепрограммирования как для фибробластов, так и для эндотелиальных клеток (1d и 1g).
Используя вышеописанный метод, ученые провели сравнение клеточных популяций пожилых испытуемых с и без перепрограммирования (TA и UA; 1a и 1e). Было установлено, что 1042 гена в фибробластах и 992 в эндотелиальных клетках были дифференцированно экспрессированы.
Затем эти транскриптомные профили были использованы для подтверждения сохранения идентичности клеток после перепрограммирования. Анализ показал, что существенных изменений идентичности не было.
В целом, анализ транскриптомных сигнатур показал, что экспрессия OSKLMN способствует очень быстрой активации более молодого профиля экспрессии генов без влияния на экспрессию генов клеточной идентичности.
Исследователи отмечают, что эпигенетические часы*, основанные на уровнях метилирования ДНК*, являются наиболее точными молекулярными биомаркерами возраста в тканях и клетках. Они также являются прогностическими для множества возрастных состояний, включая продолжительность жизни.
Эпигенетические часы* — совокупность эпигенетических меток ДНК, с помощью которых можно определить биологический возраст ткани, клетки или органа.
Метилирование ДНК* — модификация молекулы ДНК без изменения самой нуклеотидной последовательности ДНК.
Известно также и то, что экзогенная экспрессия канонических факторов репрограммирования (OSKM) возвращает эпигенетический возраст первичных клеток в пренатальное состояние
Чтобы проверить, может ли временная экспрессия OSKMLN обратить вспять эпигенетические часы соматических клеток человека, ученые использовали два типа эпигенетических часов, которые применяются к фибробластам и эндотелиальным клеткам человека: оригинальные эпигенетические часы Панвиса Хорвата (основанные на 353 парах цитозин-фосфат-гуанин) и более поздние «кожно-кровяные» часы (на основе 391 CpGs — участки молекулы ДНК).
Калькулятор эпигенетического возраста методом Ховарта
Согласно эпигенетическим часам Ховарта временное воздействие OSKMLN значительно обратило возраст метилирования ДНК (средняя разница в возрасте = -3.40 года). Эффект омоложения был более выраженным в эндотелиальных клетках (средняя разница в возрасте = -4.94 года; 1i), чем в фибробластах (средняя разница в возрасте = -1.84; 1h).
Качественно сходные, но менее значимые результаты были получены при использовании кожно-кровяных часов: общий эффект омоложения -1.35 года; среднее омоложение в эндотелиальных клетках -1.62 и в фибробластах -1.07.
На основании этих результатов был проведен анализ влияние временного перепрограммирования на различные признаки клеточного физиологического старения. Для этого проводилась визуализация отдельных клеток и обширная база признаков старения.
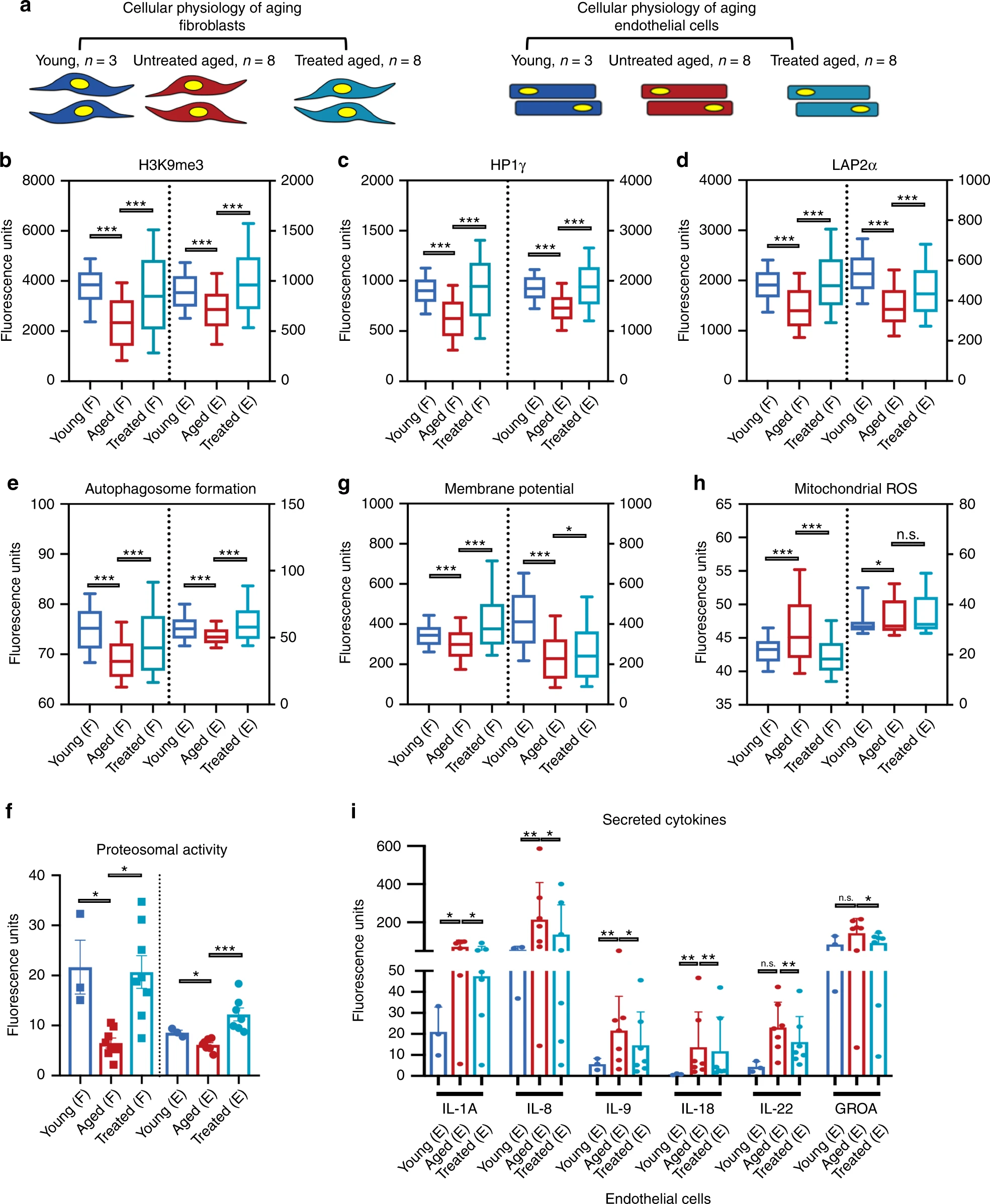
Изображение №2
Все анализы проводились отдельно в каждой отдельной клеточной линии (2a): 19 линий фибробластов (3 — молодые, 8 — пожилые и 8 — пожилые после перепрограммирования) и 17 линий эндотелиальных клеток (3 — молодые, 7 — пожилые и 7 — пожилые после перепрограммирования). Статистический анализ проводился путем случайной выборки 100 клеток на один образец.
Для расширения предыдущих результатов по эпигенетике были проведены дополнительные количественные измерения с помощью иммунофлюоресценции (IF) эпигенетической репрессивной метки H3K9me3, гетерохроматин-ассоциированного белка HP1γ и белка LAP2α, поддерживающего ядерную ламину* (2b-2d).
Ядерная ламина* — фибриллярная жесткая сеть под ядерной мембраной, которая участвует в организации хроматина.
Как уже сообщалось в ранее проведенных исследованиях, в зрелых фибробластах и эндотелиальных клетках наблюдалось снижение ядерного сигнала для всех трех маркеров по сравнению с молодыми клетками. Перепрограммирование пожилых клеток привело к увеличению этих маркеров в обоих типах клеток.
Далее была исследована протеолитическая (гидролиз белков) активность клеток путем измерения образования аутофагосом, а также изучена химотрипсиноподобная протеасомная активность. Перепрограммирование не только увеличило оба типа активности до уровня молодых клеток, но и превысило его (2e и 2f). Это говорит о том, что ранние этапы перепрограммирования способствуют активному клиренсу деградированных биомолекул.
Одними из самых показательных признаков старения клетки является снижение активности митохондрий, накопление активных форм кислорода (АФК) и нарушение регуляции чувствительности к питательным веществам. Потому можно проверить влияние перепрограммирования на стареющие клетки путем измерения мембранного потенциала митохондрий, АФК митохондрий и уровней белка Sirtuin1 (SIRT1).
Временное перепрограммирование увеличивало мембранный потенциал митохондрий в обоих типах клеток (2g), уменьшало митохондриальное АФК (2h) и повышало уровни белка SIRT1 в фибробластах, что наблюдается в молодых клетках.
Визуализация клетки посредством окрашивания ассоциированной со старением бета-галактозидазы показало значительное снижение количества стареющих клеток в эндотелиальных клетках, но не в фибробластах. Это сопровождалось снижением количества секреторных фенотипических цитокинов, ассоциированных с провоспалительным старением, и опять в эндотелиальных клетках, но не в фибробластах (2i).
Также было установлено, что ни в одном из типов клеток длина теломер* не демонстрирует значительного удлинения после перепрограммирования. Это может говорить о том, что клетки не дедифференцируются в состояние, подобное стволовым клеткам, когда активность теломеразы* реактивируется.
Теломеры* — концевые участки хромосом.Теломераза* — фермент, который добавляет специфические повторяющиеся последовательности нуклеотидов ДНК к 3'-концу цепи ДНК на участках теломер.
Также было установлено, что эффекты перепрограммирования в клетках сохранялись даже спустя 4 и 6 дней после того, как этот процесс прекращался. С точки зрения скорости проявления эффектов от перепрограммирования, то они наблюдались уже спустя 2 дня с момента начала этого процесса.
Суммарно эти данные говорят о том, что временная экспрессия OSKMLN может вызывать быстрое, постоянное улучшение и изменение клеточного возраста в соматических клетках человека на транскриптомном, эпигенетическом и клеточном уровнях. Кроме того, данное омоложение протекает на ранних этапах перепрограммирования, за счет чего эта методика не успевает повлиять на идентичность клеток.
Далее ученые решили выяснить, может ли временная экспрессия OSKMNL также обратить вспять воспалительные фенотипы, связанные со старением. После получения предварительных доказательств этого изменения в эндотелиальных клетках (2j) анализ был расширен путем добавления остеоартрита — заболевания, сильно связанного со старением и характеризующегося выраженным воспалительным процессом, затрагивающим хондроциты в суставах.
Был произведен забор образцов — хондроциты из хряща шести пациентов в возрасте 60–70 лет, перенесших полную операцию по замене сустава в связи с остеоартритом на поздней стадии. Далее эти образцы прошли перепрограммирование и результаты этого сравнивались с данными хондроцитами трех молодых людей (3а).

Изображение №3
Временная экспрессия OSKMLN выполнялась в течение 2 или 3 дней, а анализ выполнялся через 2 дня после прерывания перепрограммирования, хотя более стойкий эффект у пациентов все же был при более длительном лечении.
Тем не менее, применение OSKMLN показало значительное снижение внутриклеточных мРНК уровней RANKL (цитокин семейства факторов некроза опухоли) и iNOS2, а также уровней воспалительных факторов, секретируемых клетками (3b-3d).
Помимо этого наблюдалось увеличение пролиферации клеток (3е), увеличение продукции АТФ (3f) и снижение окислительного процесса (3g и 3h).
Проверка идентичности клеток показала, что процесс перепрограммирования не нарушил ее: влияния на уровень экспрессии SOX9 не было, а уровень экспрессии COL2A1 значительно повысился (qRT-PCR на 3i и 3j).
Из вышеописанных результатов следует, что временная экспрессия OSKMLN может способствовать частичному обращению экспрессии генов и клеточной физиологии в старых хондроцитах с остеоартритом в более молодое состояние. Следовательно, исследуемая методика может также применяться и в качестве одно из методов лечения остеоартрита у пожилых людей.
Еще один важный признак старения это потеря функции стволовых клеток и потеря регенеративной способности. Для проверки влияния перепрограммирования на эти факторы ученые использовали стволовые клетки скелетных мышц (MuSC) мышей.
MuSC были под воздействием перепрограммирования в течение 2 дней, пока находились в состоянии покоя. В качестве доноров образцов послужили особи в возрасте 3 месяца и 20–24 месяца (4а).
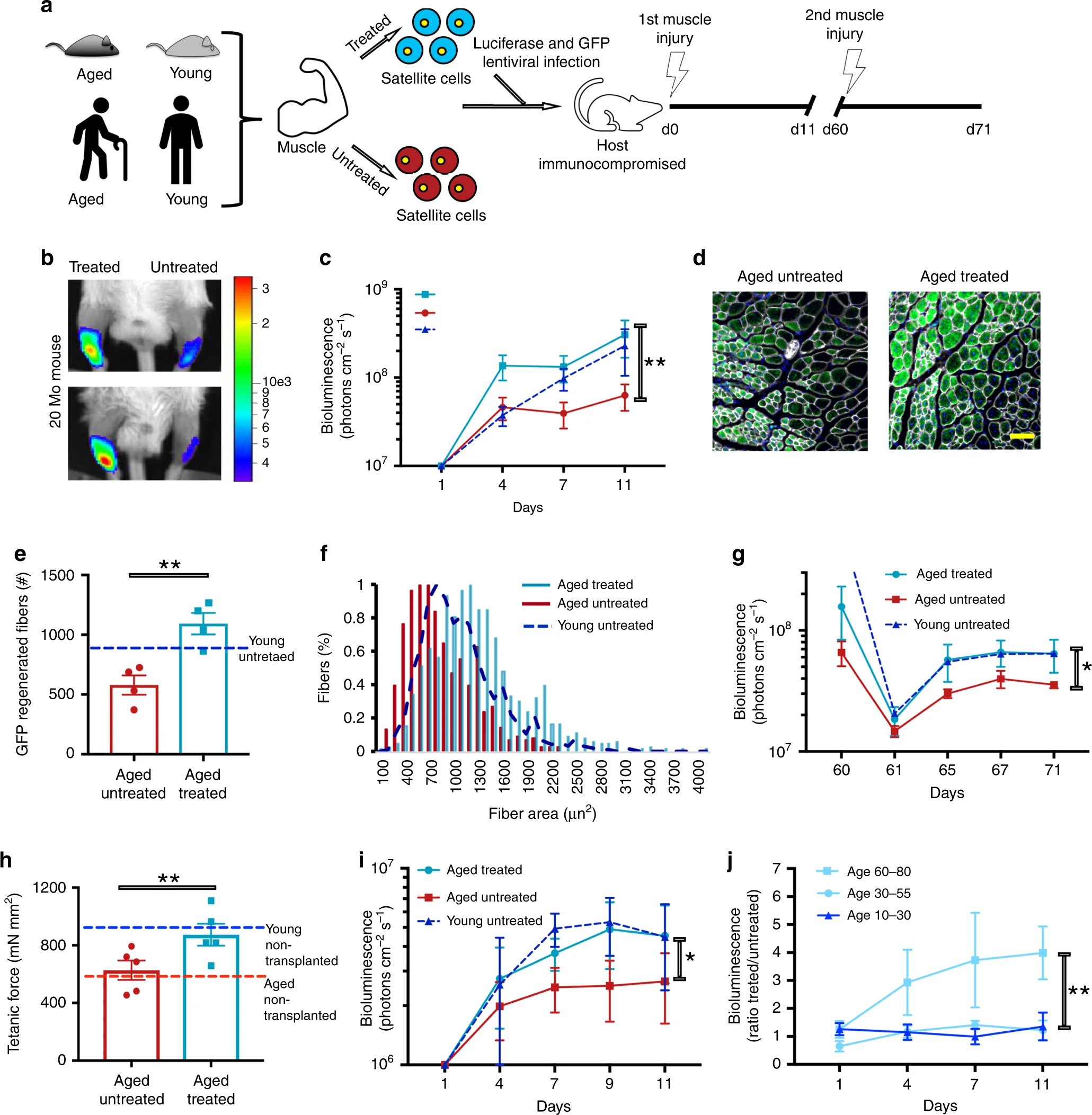
Изображение №4
Обработка старых MuSC уменьшала как время первого деления, приближаясь его к более быстрой кинетике активации молодых MuSC клеток, так и митохондриальную массу. Более того, перепрограммирование частично восстановило сниженную способность отдельных MuSC образовывать колонии.
Далее была проведена проверка функциональности и эффективности MuSC относительно регенерации новой ткани. Для этого была произведена трансдукция молодых, пожилых или временно перепрограммированных MuSC клеток с помощью лентивирус-экспрессирующей люциферазы и GFP, которые затем трансплантировали в поврежденные мышцы передней большеберцовой кости иммунокомпрометированных мышей.
Биолюминесцентная визуализация первоначально показала, что мышцы, в которые поместили перепрограммированные MuSC, показали самый высокий сигнал (день 4; 4b и 4c). Однако на 11 день эти мышцы стали похожи на мышцы, куда добавили молодые MuSC. А вот мышцы, куда добавляли стареющие MuSC клетки без перепрограммирования, показали самые слабые сигналы (4b и 4c).
Иммунофлуоресцентный анализ показал, что клетки с перепрограммированием предоставляли тканям больше миофибрилл, чем клетки без обработки (4d и 4e). Спустя 60 дней после первого анализа был проведен еще одни, который показал те же результаты (4g). Это прямо говорит об улучшении регенеративной способности тканей после воздействия на них клеток, прошедших перепрограммирование.
На следующем этапе исследования особое внимание было уделено возрастным атрофическим дегенеративным изменениям мышц. Ученые решили проверить, может ли их методика восстановить мышечную силу пожилых мышей до уровня молодых.
Сначала была установлена тетаническая* сила в мышцах мышей в возрасте 4 и 27 месяцев.
Тетанус* — состояние длительного сокращения мышцы.
Как и ожидалось, у пожилых мышей эта сила была значительно ниже, чем у молодых, что указывает на возрастной фактор (4h).
Затем из мышей в возрасте 20–24 месяца были выделены MuSC клетки, которые в дальнейшем прошли процесс перепрограммирования, а потом траснплантированы в поврежденные кардиотоксином мышцы мышей в возрасте 20 месяцев. Спустя 30 дней измерения тетанической силы были выполнены повторно.
Мышцы, в которые трансплантировали клетки без перепрограммирования, показывали такие же результаты, что и обычные мышцы пожилых мышей без какого либо вмешательства. А вот мышцы, куда поместили клетки с перепрограммированием, демонстрировали тетанические силы, сравнимые с мышцами молодых мышей (4h).
Из этого следует, что временное перепрограммирование в сочетании с терапией на основе MuSC может восстановить физиологическую функцию стареющих мышц до функций молодых мышц.
Проведение аналогичной процедуры с мышцами и клетками человека показали схожие положительные результаты (4i и 4j).
Для более подробного ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В рассмотренном нами сегодня исследовании ученые смогли продемонстрировать временное перепрограммирование клеток, которое способно бороться с признаками клеточного старения и не затрагивать при этом клеточную идентичность.
Клетки пожилых людей, прошедшие перепрограммирование, начинают демонстрировать характеристики молодых клеток уже спустя несколько дней. При этом эффект сохраняется на протяжении шести дней после прекращения лечения.
Данная методика важна не только в аспекте общего омоложения клеток и тканей, но и более конкретно в аспекте борьбы с последствиями возрастных заболеваний, таких как остеоартрит.
В дальнейшем ученые намерены совершенствовать свою методику. Во-первых, как говорят сами исследователи, необходимо провести еще уйму тестов в лабораторных условиях и полностью удостовериться в безопасности методики на уровне клеток. После этого можно будет приступить к ее применению на тканевом уровне.
Готово ли человечество к вечной молодости с точки зрения морали, этики и психологии? Вопрос сложный, а ответов у него множество. Однако цель данного исследования не в поисках бессмертия, а в поисках новых эффективных методов борьбы с различными заболеваниями, которые возникают в связи с неминуемым старением организма. Старость не так страшна, как болезни, которые с ней приходят. То же самое можно сказать про любой возраст, ибо какая радость в мифической вечной молодости, если всю эту вечность человек будет бороться с какой-то болячкой?
Бессмертие, конечно, противоречит законам природы, однако есть удивительное растение иерихонская роза, готовое поспорить с этим утверждением. (Иерихонская роза / Anastatica hierochuntica).
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! :)
Немного рекламы :)
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5–2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Equinix Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5–2697v3 2.6GHz 14C 64GB DDR4 4×960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5–2430 2.2Ghz 6C 128GB DDR3 2×960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5–2650 v4 стоимостью 9000 евро за копейки?
