Про перекись водорода и жука-ракетчика
Тема этой заметки назревала давно. И хотя по просьбе читателей канала LAB-66, я просто хотел написать про безопасную работу с перекисью водорода, но в итоге, по непонятным (вот, да!) мне причинам, образовался очередной лонгрид. Так что за смесью из popsci, ракетного топлива, «коронавирусной дезинфекции» и перманганатометрического титрования — идем под кат.
p.s. жук с картинки на самом деле называется «бомбардир». И он там тоже где-то затерялся среди химикатов :)
«детям пероксида» посвящается…
Полюбился нашему брату пероксид водорода, ох как полюбился. Думаю я об этом каждый раз, когда встречаю вопрос вроде «бутылку с перекисью водорода раздуло. что делать?» Встречаю кстати, достаточно часто :)
Не удивительно, что на пост-советских пространствах перекись водорода (3% раствор) — это один из любимых «народных» антисептиков. И на рану полить, и воду обеззараживать, и коронавирус вот уничтожать с недавних пор. Но несмотря на кажущуюся простоту и доступность, компонент это достаточно непростой, о чем я дальше и постараюсь рассказать.
По биологическим «вершкам» пройдясь…
Сейчас модно все с приставкой эко-, экологические продукты, экологические шампуни. Как я понял, люди хотят этими прилагательными отличать вещи сугубо биогенные (т.е. встречающиеся в живых организмах изначально) от вещей сугубо синтетических («жесткая химия»). Поэтому вначале небольшое введение, которое я надеюсь, подчеркнет экологичность пероксида водорода и добавит оному доверия в народных массах :)
Итак, что же такое перекись водорода. Простейшее перекисное соединение, вот что. Т.е. соединение, которое имеет в своем составе сразу два атома кислорода (вот так они соединены -O-O-). Там где такой вид связи, там и нестабильность, там вам и атомарный кислород и сильные окислительные свойства и все все все. Но несмотря на суровость атомарного кислорода, перекись водорода присутствует во множестве живых организмов, в т.ч. и в человеке. Образуется она в микро количествах во время протекания сложных биохимических процессов и окисляет белки, мембранные липиды и даже ДНК (за счет образующихся пероксидных радикалов). Наш организм в процессе эволюции научился с перекисью довольно эффективно бороться. Делает он это с помощью фермента надпероксиддисмутазы, который перекисные соединения разрушает до кислорода и простенькой перекиси водорода, и фермента каталазы который перекись на раз-два преобразуется в кислород и воду.

Кстати, именно благодаря действию каталазы, которая присутствует в тканях нашего организма, «вскипает» кровь при обработке ран (про раны ниже будет отдельная ремарка).
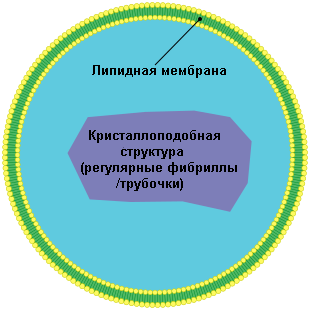
Есть у перекиси водорода внутри нас и важная «охранная функция». У многих живых организмов присутствует такая интересная органелла (структура нужная для функционирования живой клетки) как пероксисома. Эти структуры представляют собой липидные пузырьки внутри которых находится кристаллоподобное ядро, состоящее из биологических трубчатых «микрореакторов». Внутри ядра происходят различные биохимические процессы, в результате которых из кислорода воздуха и сложных органических соединений липидной природы образуется….перекись водорода!
Но здесь интереснее всего, для чего потом эта перекись используется. Например в клетках печени и почек образующаяся H2O2 идет на то, чтобы разрушать и нейтрализовать поступающие в кровь токсины. Ацетальдегид, который образуется при метаболизме алкогольных напитков (и который ответственен за похмелье) — это тоже заслуга наших маленьких неутомимых тружеников пероксисом, и «матушки» перекиси водорода.
Чтобы все не казалось уж таким радужным с перекисями, внезапно напомню про механизм действия радиации на живую ткань. Молекулы биологических тканей поглощают энергию излучения и ионизируются, т.е. переходят в состояние способствующее образованию новых соединений (чаще всего совершенно не нужных в рамках организма). Чаще и проще всего подвергается ионизации вода, происходит ее радиолиз. В присутствии кислорода под воздействием ионизирующей радиации возникают различные свободные радикалы (OH- и иже с ними) и перекисные соединения (H2O2 в частности).

Образующиеся пероксиды активно вступают во взаимодействие с химическими соединениями организма. Хотя если взять в качестве примера иногда образующийся в процессе радиолиза надпероксидный анион (О2-), то стоит сказать что этот ион образуется и в обычных условиях, в абсолютно здоровом организме, без свободных радикалов нейтрофилы и макрофаги нашего иммунитета не могли бы уничтожать бактериальные инфекции. Т.е. совсем без этих свободных радикалов никак нельзя — они сопровождают биогенные реакции окисления. Проблема возникает когда их становится слишком много.
Именно для борьбы с «слишком много» пероксидных соединений и придуманы человеком такие штуки, как антиоксиданты. Они ингибируют процессы окисления сложной органики с образованием пероксидных и т.п. свободных радикалов и тем самым снижают уровень окислительного стресса.
Окислительный стресс — это процесс повреждения клетки в результате окисления (= в организме слишком много свободных радикалов)
Хотя по сути, ничего нового эти соединения не дают, к тому, что уже имеется, т.е. «внутренних антиоксидантов» — надпероксиддисмутазы и каталазы. Да и вообще, при неправильном использовании синтетические антиоксиданты не только не помогут, а этот самый окислительный стресс еще и усилят.
Ремарка про «перекись и раны». Несмотря на то, что перекись водорода является завсегдатаем домашних (и производственных аптечек), есть данные, говорящие о том, что использование H2O2 препятствует заживлению раны и вызывает образование рубцов, потому что перекись разрушает новообразованные клетки кожи. Положительный эффект дают только очень низкие концентрации (0,03% раствор, это значит надо разбавить 3% аптечный в 100 раз), и только при однократном применении. Кстати, «коронавирус ready» 0,5% раствор тоже препятствует заживлению. Так что, как говорится, доверяй, но проверяй.
Перекись водорода в быту и «против коронавируса»
Если перекись водорода может даже этанол в печени превратить в ацетальдегид, то было бы странно эти ее замечательные окислительные свойства не использовать в повседневной жизни. Они и используются в таких вот пропорциях:
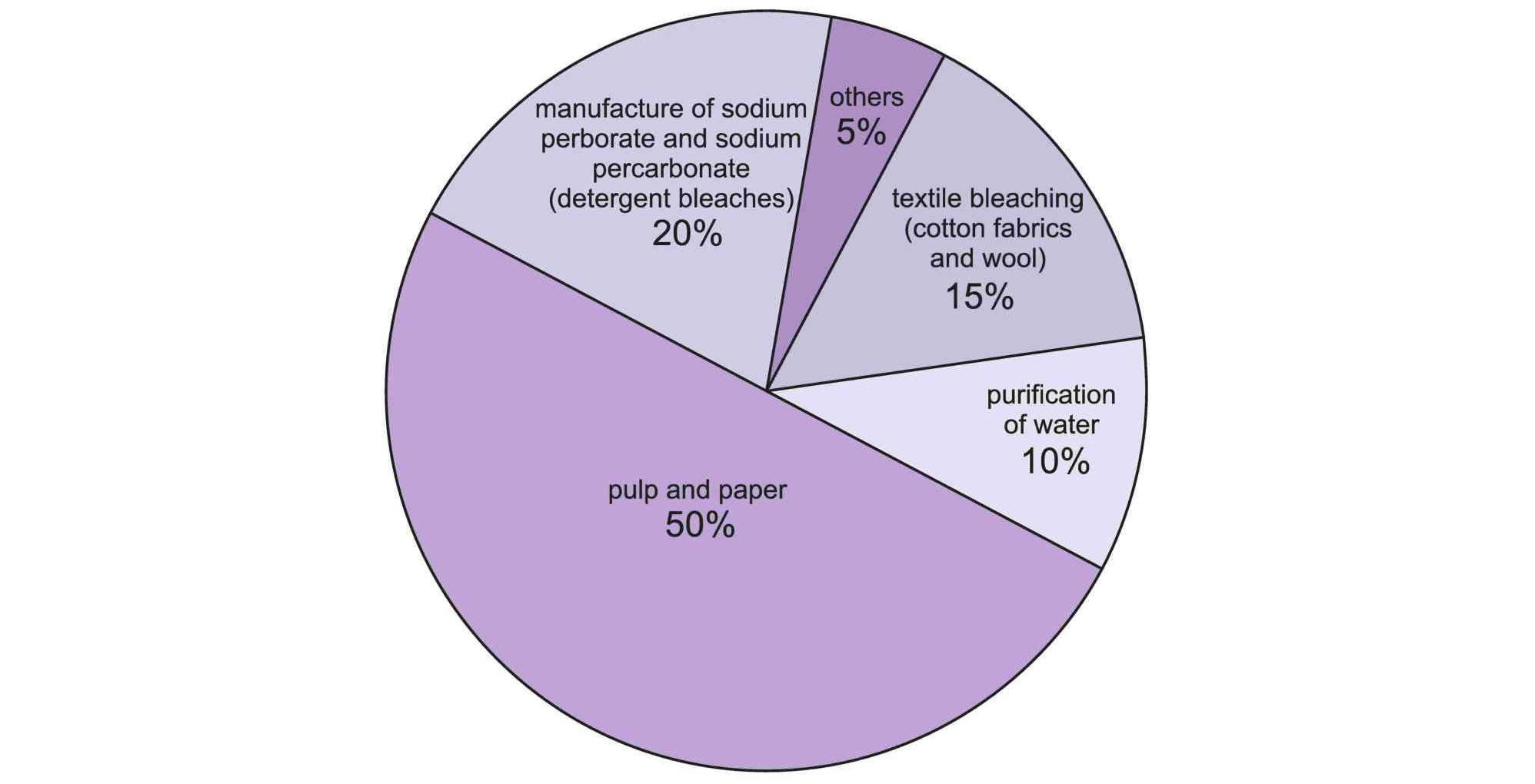
Половина всей производимой химической промышленностью перекиси водорода идет для отбеливания целлюлозы и различных видов бумаги. Второе место (20%) по востребованности занимает получение различных отбеливателей на основе неорганических пероксидов (перкарбонат натрия, перборат натрия и т.д. и т.п.). Эти пероксиды (часто в комбинации с ТАЕД для снижения температуры отбеливания, т.к. пероксосоли не работают при температуре ниже 60 градусов) используются во всяких «Персоль» и т.п. (подробнее можно посмотреть здесь). Потом идет с небольшим отрывом отбеливание тканей и волокон (15%) и очистка воды (10%). Ну и наконец доля которая остается — поровну делится между сугубо химическими вещами и использовании перекиси водорода для медицинских целей. На последних остановлюсь подробнее ибо скорее всего пандемия коронавируса цифры на диаграмме изменит (если уже не изменила).
Перекись водорода активно используется для стерилизации различных поверхностей (в т.ч. хирургических инструментов), а в последнее время еще и в виде пара (т.н. VHP — vaporized hydrogen peroxide) для стерилизации помещений. На рисунке ниже пример такого генератора пара перекиси. Очень перспективное направление, которое до отечественных больниц пока не добралось…

В целом перекись демонстрирует высокую эффективность дезинфекции для широкого спектра вирусов, бактерий, дрожжей и бактериальных спор. Стоит отметить, что для сложных микроорганизмов, из-за присутствия в них ферментов, разлагающих перекись (т.н. пероксидазы, частным случаем которых является и упомянутая выше каталаза) может наблюдаться толерантность (~устойчивость). Особенно это характерно для раствором с концентрацией ниже 1%. Но против 3%, а уж тем более 6–10% не может устоять пока ничего, ни вирус, ни бактериальная спора.
Фактические, наравне с этиловым и изопропиловым спиртом да гипохлоритом натрия, пероксид водорода входит в список «жизненно-важных» экстренных антисептиков для дезинфекции поверхностей от COVID-19. Хотя не только от COVID-19. в В начале всей коронавирусной вакханалии мы с читателями телеграм-канала активно пользовались при выборе антисептиков рекомендациями из статьи. Рекомендации применимы к коронавирусам в целом, ну и COVID-19 в частности. Так что статью рекомендую скачать и распечатать (для интересующихся этим вопросом).
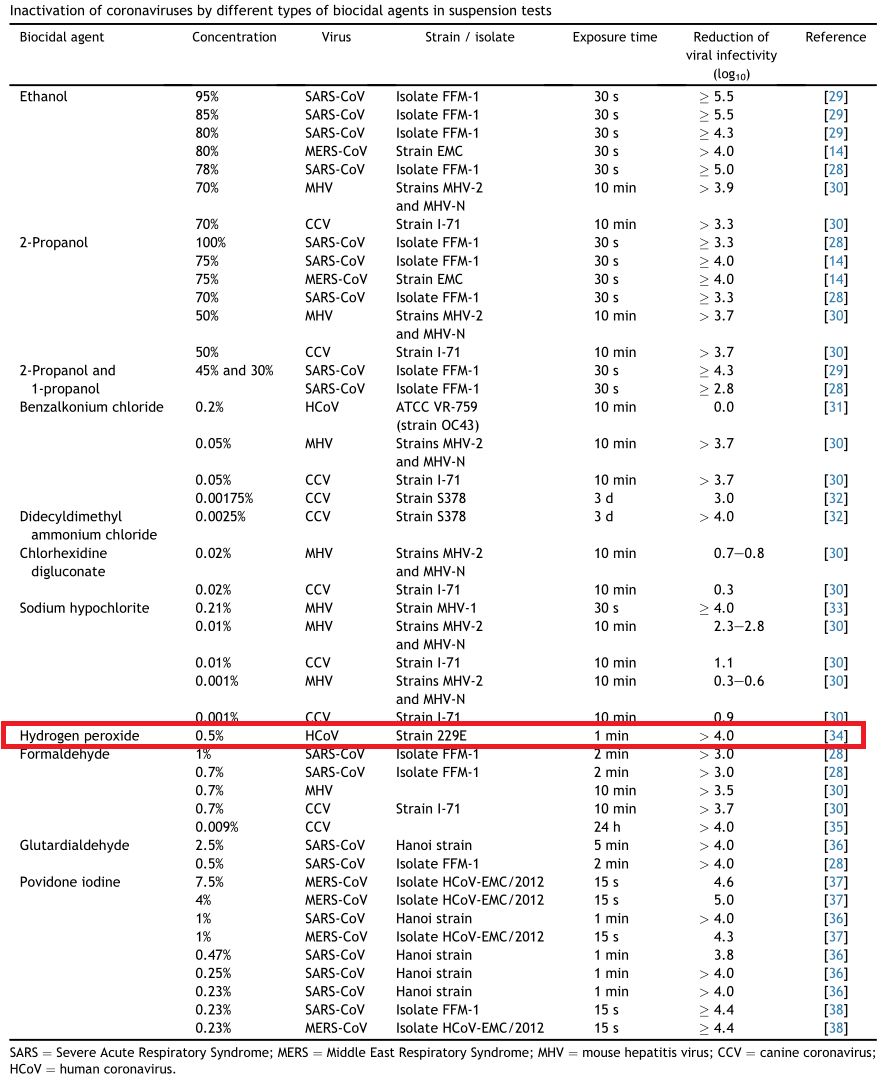
За то время, что прошло с момента начала эпидемии, особенно ничего не поменялось в плане работающих концентраций. Зато поменялось, например, в отношении форм, в которых может использоваться перекись водорода. Здесь сразу хотелось бы вспомнить документ EPA«s Registered Antimicrobial Products for Use Against Novel Coronavirus SARS-CoV-2, the Cause of COVID-19 с составами рекомендуемых для дезинфекции средств. Меня в этом списке традиционно заинтересовали салфетки (традиционно, потому что дезсалфетки мне нравятся, гипохлоритные я уже делал, и доволен ими на все 100%). В данном случае меня заинтересовал такой американский продукт как Oxivir Wipes (или его аналог Oxivir 1 Wipes) от компании Diversey Inc.

В активных ингредиентах там указано немногое:
Hydrogen Peroxide 0.5%
Простенько и со вкусом. Но тем, кто захочет повторить такой состав и пропитать свои custom-ные влажные салфетки скажу, что кроме перекиси водорода в пропиточном растворе присутствуют еще и:
Phosphoric acid (фосфорная кислота — стабилизатор) 1–5%
2-Hydroxybenzoic Acid (салициловая кислота) 0,1–1,5%
Зачем все эти «примеси» станет ясно, когда дочитаете до раздела про стабильность.
Помимо состава хотелось бы также напомнить, что гласит инструкция на упомянутые Oxivir. Ничего принципиально нового (относительно первой таблицы), но мне понравился спектр дезинфицируемых вирусов.
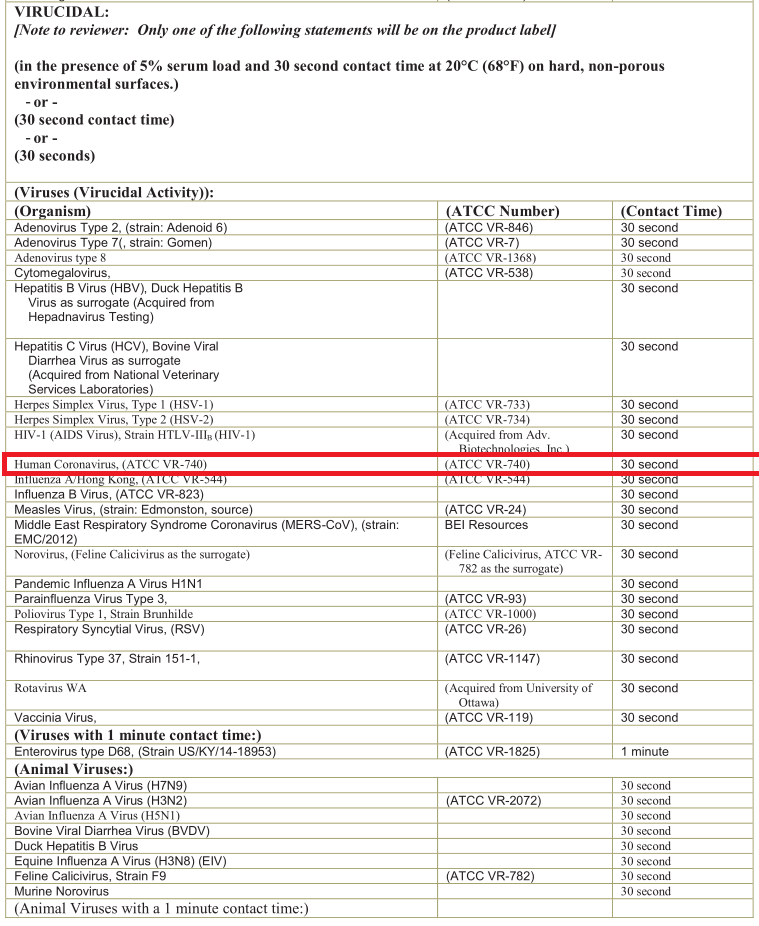
И не был бы я собой, если бы еще раз не напомнил про экспозицию при обработке. Как и раньше (=как и всегда) рекомендуется делать так, чтобы при протирании влажными салфетками все твердые, НЕпористые поверхности оставались визуально влажными на протяжении как минимум 30 секунд (а лучше минута!) для дезактивации всего и вся (и этого вашего COVID-19 тоже).
Перекись водорода как химикат
Вокруг да около прошлись, теперь пришло время написать про перекись водорода, с точки зрения химика. Благо именно этот вопрос (а не то, как пероксисома выглядит) чаще всего интересует неискушенного пользователя, который решил использовать H2O2 для своих целей. Начнем с трехмерной структуры:
Чистый пероксид представляет собой прозрачную (с голубоватым оттенком для высоких концентраций) жидкость. Плотность разбавленных растворов близка к плотности воды (1 г/см3), концентрированные более плотные (35% — 1,13 г/см3…70% — 1,29 г/см3 и т.д.). По плотности (при наличии ареометров) можно достаточно точно определить концентрацию своего раствора (информация из статьи).
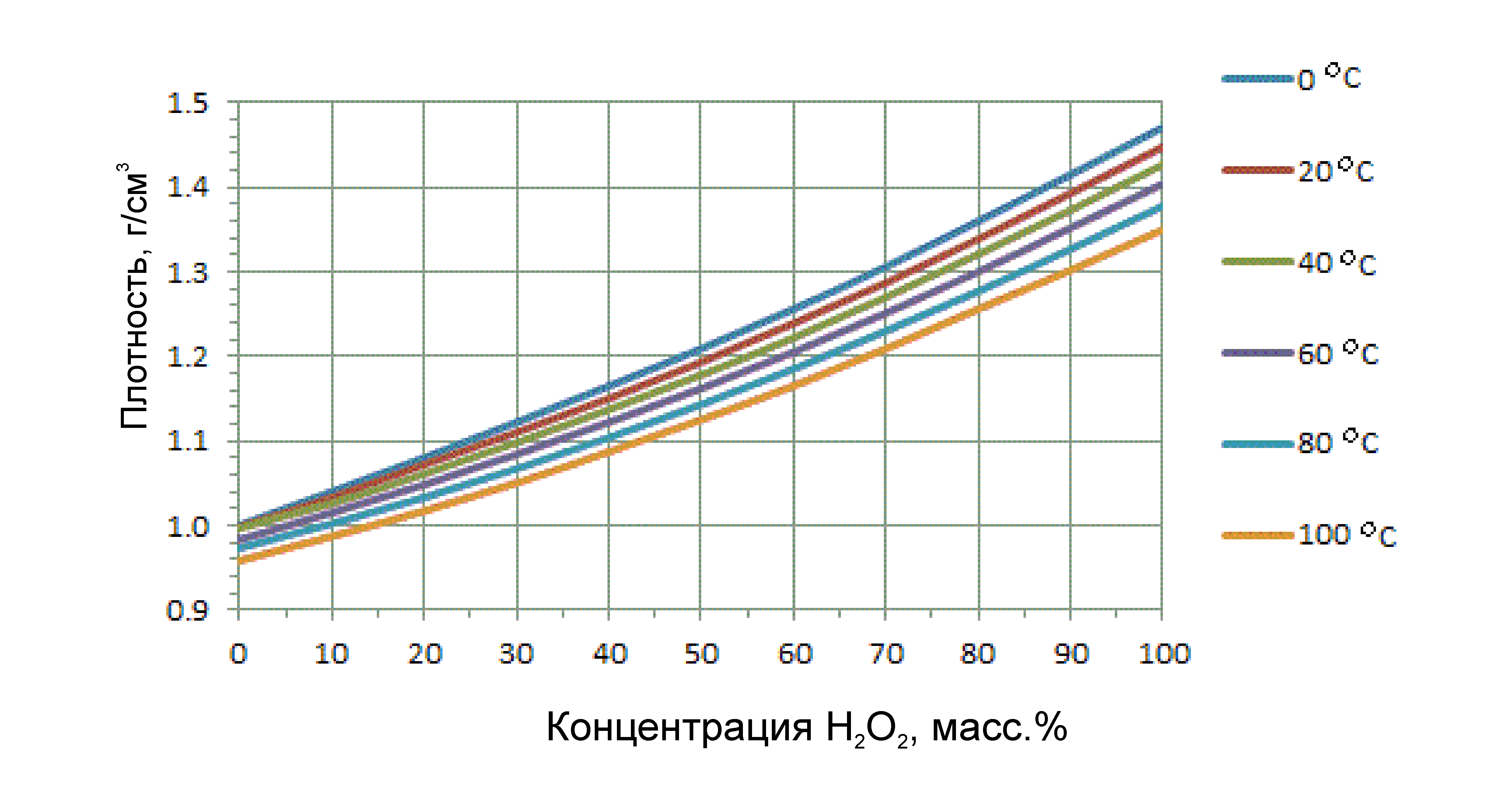
Отечественная техническая перекись водорода может быть трех марок: А=концентрация 30–40%, Б=50–52%, В=58–60%. Часто встречается такое наименование как «пергидроль» (было когда-то даже выражение «пергидрольная блондинка»). По сути ж — все та же «марка А», т.е. раствор перекиси водорода с концентрацией около 30%.
Ремарка про отбеливание. Раз уж про блондинок вспомнили, то можно отметить, что в качестве отбеливающего состава для «опергидроливания» волос использовали разбавленную перекись водорода (2–10%) и нашатырный спирт. Сейчас это уже редко практикуется. Зато встречается перекисное отбеливание зубов. Кстати, побеление кожи рук после контакта с перекисью — это тоже своеобразное «опергидроливание», вызванное тысячами микроэмболий, т.е. закупорок капилляров образовавшимися при разложении перекиси пузырьками кислорода.
Медицинской техническая перекись становится, когда к перекиси концентрацией 59–60% добавляют обессоленную воду, разбавляя концентрат до нужного уровня (3% на отечественных просторах, 6% в США).
Помимо плотности, важным параметром является уровень pH. Пероксид водорода является слабой кислотой. На картинке ниже показана зависимость рН раствора перекиси водорода от массовой концентрации:
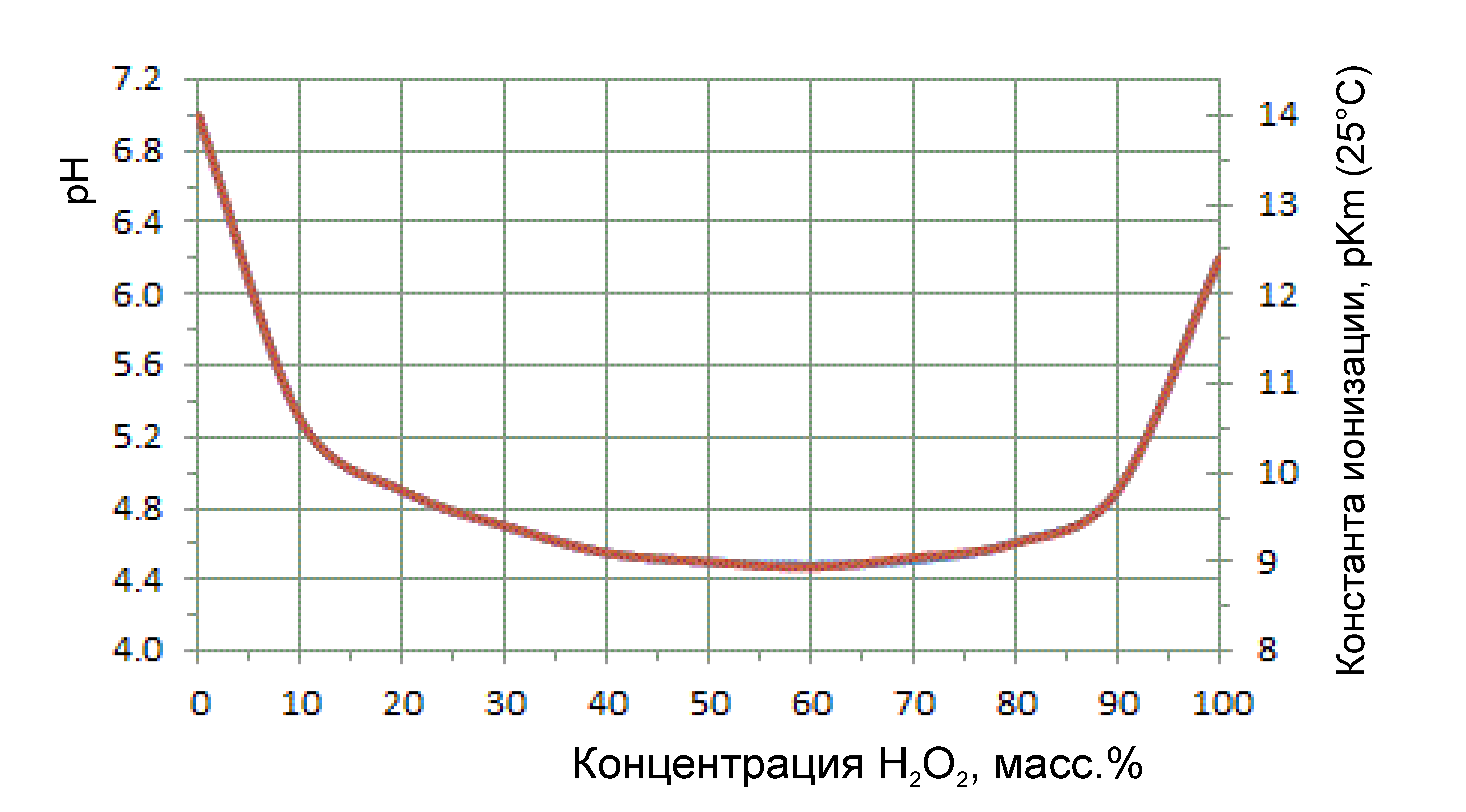
Чем более разбавленный раствор, тем ближе его рН к рН воды. Минимальный рН (=самый кислый) приходится на концентрации 55–65% (марка В по отечественной классификации).
Хотя здесь скрепя сердце стоит отметить, что рН нельзя использовать для количественной оценки концентрации по нескольким причинам. Во-первых, практически вся современная перекись получается с помощью окисления антрахинонов. В этом процессе образуются кислотные побочные продукты, которые могут попадать в готовую перекись. Т.е. рН может отличаться от того, который указан в таблице выше в зависимости от степени чистоты H2O2. Сверхчистая перекись (например, которая идет для ракетного топлива и о которой я еще скажу отдельно) примесей не содержит. Во-вторых, в продажную перекись водорода часто добавляют кислотные стабилизаторы (перекись более стабильна при низких рН), которые будут «смазывать» показания. Ну и в-третьих, стабилизаторы-хелаты (для связывания примесей металлов, о них подробнее ниже) тоже могут быть щелочными или кислотными и влиять на рН итогового раствора.
Лучший способ определения концентрации — титрование (как и в случае гипохлорита натрия ~ «Белизна»). Методика абсолютно та же, но только все реактивы, необходимые для проведения испытания — очень легкодоступны. Нужна концентрированная серная кислота (аккумуляторный электролит) да обычная марганцовка. Как кричал когда-то Б. Гейтс »640 кб памяти хватит всем!», так же воскликну и я сейчас «Титровать перекись могут все!» :). Несмотря на то, что интуиция мне подсказывает, что если покупать перекись водорода в аптеке и не хранить ее десятилетиями — то колебания концентрация навряд ли превысят ± 1%, все-таки методику проверки изложу, благо реактивы доступные и алгоритм достаточно прост.
Алгоритм проверки следующий:
1. Готовим 0,1N раствор перманганата калия. Для этого растворяем 3,3 грамма марганцовки в 1 л воды. Раствор нагреваем до кипения и кипятим 15 минут.
2. Отбираем требуемый объем исследуемой перекиси (в зависимости от предполагаемой концентрации, т.е. если у вас было 3%, ожидать что там внезапно стало 50% — глупо):
Переносим отобранный объем в бутылочку и взвешиваем на весах (не забыв нажать кнопку Тара, чтобы не учитывать вес самой бутылки)
3. Переливаем наш образец в мерную колбу на 250 мл (или детскую бутылочку с маркировкой объема) и доливаем до метки (»250») дистиллированной водой. Перемешиваем.
4. В коническую колбу на 500 мл (=«поллитровая банка») наливаем 250 мл дистиллированной воды, добавляем 10 мл концентрированной серной кислоты и 25 мл нашего раствора из п.3
5. Капаем по каплям (желательно из пипетки, на которой нанесена маркировка объема) раствор 0,1N марганцовки в нашу поллитровую банку из п.4. Капнули — перемешали, капнули — перемешали. И так продолжаем до тех пор, пока прозрачный раствор не приобретет слабо розоватый оттенок. В результате реакции перекись разлагается с образованием кислорода и воды, а марганец (VI) в марганцовке восстанавливается до марганца (II).
5H2O2 + 2KMnO4 + 4H2SO4 = 2KHSO4 +2MnSO4 + 5O2 + 8H2O
6. Считаем концентрацию нашей перекиси: С H2O2 (масс.%) =[Объем раствора марганцовки в мл*0,1×0,01701×1000]/[масса образца в граммах, из п.2]
PROFIT!!!
Свободные рассуждения на тему стабильности при хранении
Перекись водорода считается соединением нестабильным, которое склонно с самопроизвольному разложению. Скорость разложения увеличивается с повышением температуры, концентрации и pH.Т. е. в общем работает правило:
…холодные, разбавленные, кислые растворы демонстрируют наилучшую стабильность…
Разложению способствуют: повышение температуры (увеличение скорости в 2,2 раза на каждые 10 градусов Цельсия, а при температуре около 150 градусов концентраты вообще лавинообразно разлагаются со взрывом), увеличение рН (особенно при рН> 6–8)
Ремарка про стекло: хранить в стеклянных бутылках можно только подкисленную перекись, т.к. стекло имеет свойство при контакте с чистой водой давать щелочную среду, а значит будет способствовать ускоренному разложению.
Влияет на скорость разложения и наличие примесей (особенно переходных металлов, таких как медь, марганец, железо, серебро, платина), воздействие ультрафиолета. Чаще всего основная комплексная причина — это рост рН и наличие примесей. В среднем, при STP условиях 30% перекись водорода теряет примерно 0,5% основного компонента в год.
Для удаления примесей используют ультратонкую фильтрацию (исключение частиц) или хелаты (комплексообразователи), связывающие ионы металлов. В качестве хелатов могут использоваться ацетанилид, коллоидный станнат или пирофосфат натрия (25–250 мг/л), органофосфонаты, нитраты (+регуляторы рН и ингибиторы коррозии), фосфорную кислоту (+регулятор рН), силикат натрия (стабилизатор).
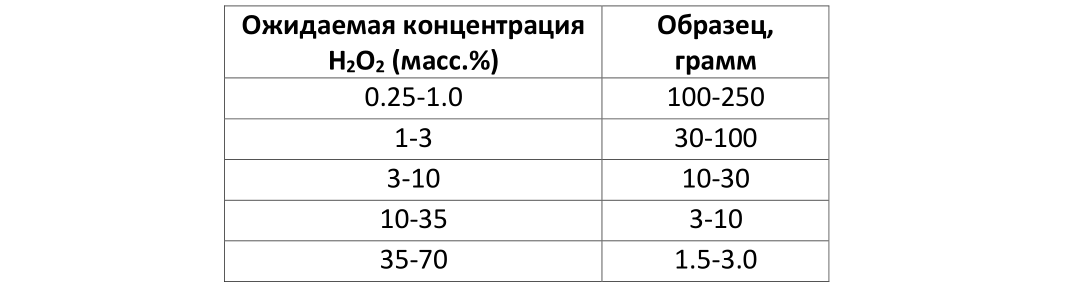
Влияние ультрафиолета на скорость разложения не так выражено, как для рН или температуры, но тоже имеет место быть (см. картинку):
Видно, что коэффициент молекулярной истинкции растет с уменьшением длины волны ультрафиолета.
Коэффициент молярной экстинкции является характеристикой того, насколько сильно химическое вещество поглощает свет на заданной длине волны.
Кстати, этот процесс разложения, инициированный фотонами называется фотолиз:
Фотолиз (он же фотодиссоциациея и фоторазложение) представляет собой химическую реакцию, в которой химическое вещество (неорганическое или органическое) расщепляется фотонами после их взаимодействия с молекулой-мишенью. Вызвать разложение может любой фотон с достаточной энергией (более высокой, чем энергия диссоциации целевой связи). Эффект, аналогичный эффекту ультрафиолета могут давать также рентгеновские лучи и γ-лучи.
Что можно сказать в целом. А то, что перекись следует хранить в непрозрачном контейнере, а лучше вообще в бутылках из коричневого стекла, которые блокируют лишний свет. Рядом с рентген-аппаратом бутылочку перекиси также держать не стоит :) Ну и от такого вот (УР 203Ех (?):

… от «такого вот» перекись (да и себя любимого, если уж начистоту) тоже держать нужно подальше.
Важно, что помимо непрозрачности, контейнер/бутылка должен быть из «перекисьустойчивых» материалов, вроде нержавеющей стали или стекла (ну + некоторые пластмассы и алюминиевые сплавы). Для ориентировки может пригодится табличка (пригодится в т.ч. врачам, которые собираются обрабатывать свое оборудование):
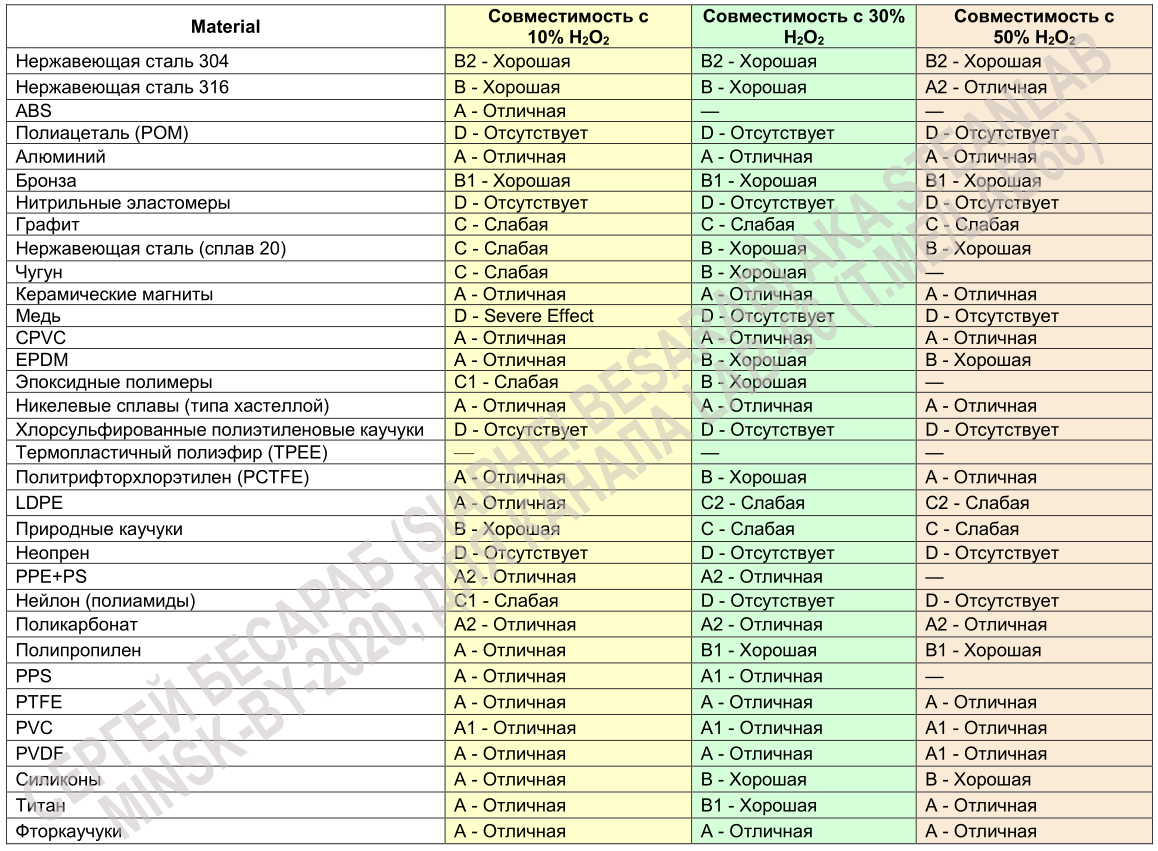
Легенда таблички следующая: А — отличная совместимость, B — хорошая совместимость, незначительное воздействие (микрокоррозия или изменение цвета), С — слабая совместимость (не рекомендуется для длительного использования, возможна потеря прочности и т.п.), D- совместимость отсутствует (=использовать нельзя). Прочерк означает «информация отсутствует». Цифровые индексы: 1 — удовлетворительно при 22° C, 2 — удовлетворительно при 48° C, 3 — удовлетворительно, при использовании в прокладках и уплотнениях.
Техника безопасности при работе с перекисью водорода
Каждому кто дочитал до этого раздела скорее всего ясно, что перекись — это сильный окислитель, а значит ее крайне необходимо хранить вдали вдали от легковоспламеняющихся/горючих веществ и восстановителей. H2O2 как в чистом, так и в разбавленном виде может образовывать взрывоопасные смеси при контакте с органическими соединениями. Учитывая все выше сказанное, можно написать так
Перекись водорода несовместима с горючими материалами, любыми горючими жидкостями и металлами и их солями (в порядке снижения каталитического действия) — осмий, палладий, платина, иридий, золото, серебро, марганец, кобальт, медь, свинец
Говоря про металлические катализаторы разложения нельзя отдельно не сказать про осмий. Это не только самый плотный металл на Земле, он еще и лучшее в мире оружие для разложения перекиси водорода.

Эффект ускорения разложения перекиси водорода для этого металла наблюдается в количествах, которые даже не каждым аналитическим методом возможно обнаружить — чтобы очень эффективно (х3-х5 раз относительно перекиси без катализатора) перекись разложить на кислород и воду нужен всего лишь 1 грамм осмия на 1000 тонн пероксида водорода.
Ремарка про «взрывной характер»: (сразу хотел написать «я-перекись», но постеснялся). В случае перекиси водорода, сферическая девочка Саша, которой с этой перекисью приходится работать, чаще всего боится взрыва. И в принципе, в опасениях Александры есть здравый смысл. Ведь перекись может взорваться по двум причинам. Во-первых от того, что в герметичном контейнере будет протекать постепенное разложение H2O2, выделение и накопление кислорода. Давление внутри контейнера будет расти, расти и в итоге БУМ! Во-вторых есть вероятность того, что при контакте перекиси водорода с какими-то веществами произойдет образование неустойчивых пероксидных соединений, которые могут сдетонировать от удара, нагрева и т.п. В классном пятитомнике Sax«s Dangerous Properties of Industrial Materials по этому поводу сказано столько, что я даже решил это спрятать под спойлер. Информация применима для концентрированной перекиси водорода >= 30% и <50%:
взрывается при контакте с: спирты+серная кислота, ацеталь+уксусная кислота+нагрев, уксусная кислота+N-гетероциклы (выше 50 °C), ароматические углеводороды+трифторуксусная кислота, азелаиновая кислота+серная кислота (около 45 °C), трет-бутанол+серная кислота, карбоксильные кислоты (муравьиная, уксусная, винная), дифенилдиселенид (выше 53 °C), 2-этоксиэтанол+полиакриламидный гель+толуол+нагрев, галий+соляная кислота, сульфат железа (II)+азотная кислота+карбоксиметилцеллюлоза, азотная кислота + кетоны (2-бутанон, 3-пентанон, циклопентанон, циклогексанон), азотистые основания (аммиак, гидразин гидрат, диметилгидразин), органические соединения (глицерин, уксусная кислота, этанол, анилин, хинолин, целлюлоза, угольная пыль), органические материалы + серная кислота (особенно в ограниченном пространстве), вода + кислородсодержащая органика (ацетальдегид, уксусная кислота, ацетон, этанол, формальдегид, муравьиная кислота, метанол, пропанол, пропаналь), винилацетат, спирты+хлорид олова, оксид фосфора (V), фосфор, азотная кислота, антимонит, трисульфид мышьяка, хлор+гидроксид калия+хлорсульфоновая кислота, сульфид меди, сульфид железа (II), муравьиная кислота+органические загрязнения, селенид водорода, ди- и моноксид свинца, сульфид свинца (II), диоксид марганцы, оксид ртути (I), дисульфид молибдена, иодат натрия, оксид ртути (II)+ азотная кислота, диэтиловый эфир, этилацетат, тиомочевина+уксусная кислота
загорается при контакте с: фурфуриловым спиртом, порошкообразные металлы (магний, цинк, железо, никель), древесные опилки
бурная реакция с: изопропоксид алюминия+соли тяжелых металлов, древесный уголь, каменный уголь, тетрагидроалюминат лития, щелочные металлы, метанол+фосфорная кислота, ненасыщенные органические соединения, хлорид олова (II), оксид кобальта, оксид железа, гидроксид свинца, оксид никеля
В принципе, если относится к концентрированной перекиси уважительно, и не комбинировать с указанным выше веществами, то можно годами комфортно работать и ничего не бояться. Но береженого и бог бережет, поэтому плавно переходим к средствам индивидуальной защиты.
СИЗ и ликвидация последствий
Идея написания статьи возникла когда я решил сделать заметку в канал, посвященную вопросам безопасной работы с концентрированными растворами H2O2. Благо очень многие читатели приобрели себе канистры с пергидролем (на случай «в аптеке ничего нет»/«до аптеки не дойдем») и даже успели сгоряча получить химические ожоги. Поэтому большая часть написанного ниже (да и выше) относится в основном к растворам с концентрацией выше 6%. Чем выше концентрации — тем актуальнее наличие СИЗ.
Для безопасной работы, в качестве средств индивидуальной защиты всего-то нужны перчатки из поливинилхлорида/бутилкаучука, полиэтилена, полиэфирных и других пластиков для защиты кожи рук, очки или защитные маски из прозрачных полимерных материалов для защиты глаз. Если образуются аэрозоли — добавляем к комплекту респиратор с противоаэрозольной защитой (а лучше вообще угольный ABEK фильтропатрон с P3 защитой). При работе со слабыми растворами (up to 6%) достаточно перчаток.
На «поражающих эффектах» остановлюсь подробнее. Перекись водорода это умеренно опасное вещество, при попадании на кожу и в глаза вызывает химические ожоги. Вреден при вдыхании и проглатывании. См. картинку из SDS («Окислитель»-«Корродирует»-«Раздражитель»):

Чтобы не ходить вокруг да около — сразу и напишу о том, что делать, если перекись водорода концентрацией от 3% вступила в контакт с неким сферическим человеком без средств индивидуально защиты.
При попадании на кожу — стереть сухой тряпкой, или тампоном смоченным спиртом. Затем необходимо промывать поврежденную кожу обильной струей воды в течении 10 минут.
При попадании в глаза — немедленно промыть широко раскрытые глаза, а также под веками слабой струей воды (или 2% раствором питьевой соды) не менее 15 минут. Обратится к врачу-офтальмологу.
При проглатывании — обильное питье (=простая вода литрами), активированный уголь (1 таблетка на 10 кг веса), солевое слабительное (сульфат магния). Не вызывать рвоту (=промывание желудка ТОЛЬКО врачом, с помощью зонда, и никаких привычных уже «два пальца в рот»). Не давать что либо через рот человеку без сознания.
Вообще проглатывание особенно опасно, так как при разложении в желудке образуется большое количество газа (в 10 раз больше объема 3% раствора), что приводит к вздутию живота и сдавливанию внутренних органов. Для этого и нужен активированный уголь…
Если с лечением последствий для организма все более или менее понятно, то стоит еще пару слов сказать и про утилизацию лишней/старой/разлитой по неопытности перекиси водорода.
… утилизация перекиси водорода производится либо а)разбавлением водой и сливом в канализацию, либо б)разложением с помощью катализаторов (пиросульфит натрия и т.п.), либо в)разложением нагревом (в т.ч. кипячение)
Как это все выглядит на примере. Например в лаборатории разлил я нечаянно литр 30% перекиси водорода. Ничего не вытираю, а засыпаю жидкость смесью равных количеств (1:1:1) кальцинированной соды+песка+бентонита (=«бентонитовый наполнитель для лотков»). Затем эту смесь смачиваю водой до образования кашицы, кашицу совком собираю в контейнер, и переношу в ведро с водой (заполнены две трети). И уже в ведро с водой я постепенно добавляю раствор пиросульфита натрия с 20% избытком. Чтобы все это дело нейтрализовать по реакции:
Na2S2O5 + 2H2O2 = Na2SO4 + H2SO4 + H2O
Если соблюдать условия задачи (литр 30% раствора) то выходит что для нейтрализации нужно 838 грамм пиросульфита (с избытком выходит килограмм соли). Растворимость этого вещества в воде ~ 650 г/л, т.е. примерно полтора литра концентрированного раствора понадобится. Мораль такова — либо не разливайте пергидроль на пол, либо разводите его посильнее, а то не наберетесь нейтрализаторов :)
При поиске возможных замен пиросульфиту, Капитан Очевидность рекомендует использовать те реагенты, которые при реакции с перекисью водорода не дают аховые объемы газа. Это может быть например сульфат железа (II). Он продается в хозяйственных магазинах и даже в РБ. Для нейтрализации H2O2 требуется подкисленный серной кислотой раствор:
2FeSO4 + H2O2 + H2SO4 = Fe2(SO4)3 + 2H2O
Можно использовать и иодид калия (тоже подкисленный серной кислотой):
2KI + H2O2 + H2SO4 = I2 + 2H2O + K2SO4
Напомню, что все рассуждения строятся на вводных задачи (30% р-р), если вы разлили перекись концентрациями пониже (3–7%) то можно использовать и подкисленный серной кислотой перманганат калия. Если кислород там даже и выделяется, то благодаря низким концентрациям «наворотить дел» он не сможет при всем желании.
Про жука
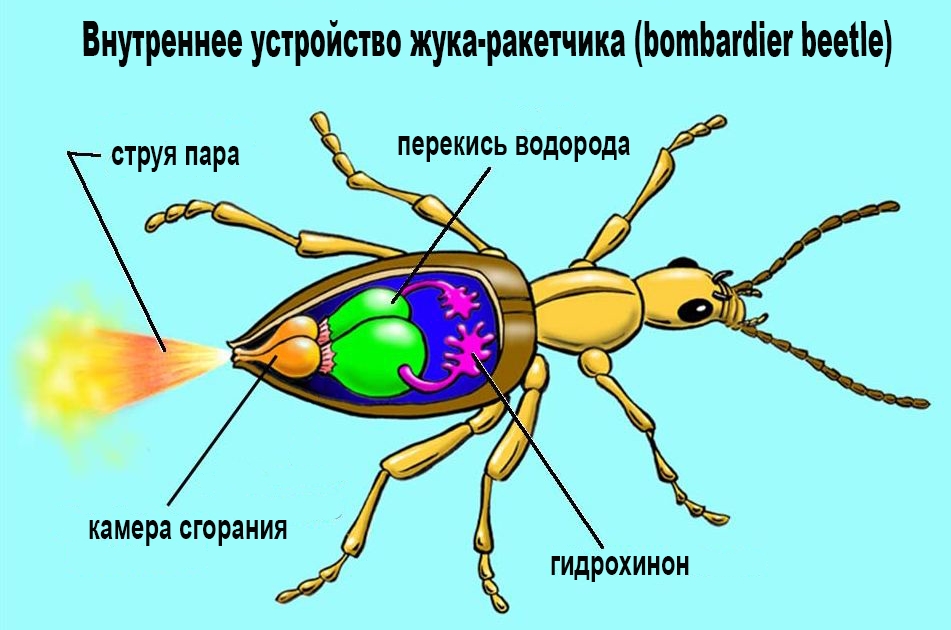
А я не забыл про него, родимого. Будет в качестве награды тем, кто дочитал очередной мой longread. Не знаю задумывался ли 30 лет назад уважаемый Алексей JetHackers Стаценко aka MagisterLudi о своих реактивных ранцах, но вот у меня точно какие-то такие мысли возникали. Особенно, когда на VHS кассете доводилось смотреть (а то и пересматривать) светлую диснеевскую сказку-фильм «Ракетчик» (в оригинале Rocketeer).

Связь здесь следующая. Как я писал ранее, перекись водорода высоких концентраций (вроде отечественной марки В) с высокой степенью очистки (прим. — т.н. high-test peroxide или HTP) может использоваться в качестве топлива в ракетах (и торпедах). Притом использоваться она может как в виде окислителя в двухкомпонентных двигателях (например, как замена жидкого кислорода), так и в виде т.н. монотоплива. В последнем случае H2O2 закачивается в «камеру сгорания», где разлагается на металлическом катализаторе (любой из металлов, упомянутых ранее в статье, например, серебро или платина) и под давлением, в виде пара с температурой около 600 °C, выходит из сопла, создавая тягу.
Самое интересное, что такое же внутреннее устройство («камера сгорания», сопла и т.п.) имеет внутри своего тельца небольшой жук из подсемейства жужелиц. Жук-бомбардир он называется официально, но мне вот его внутреннее устройство (=картинка в начале статьи) напоминает агрегат из упомянутого выше фильма 1991 года :)

Бомбардиром жучок называется потому как способен более или менее прицельно выстреливать из желёз в задней части брюшка кипящей жидкостью с неприятным запахом.
Температура выброса может достигать 100 градусов по Цельсию, а скорость выброса 10 м/с. Один выстрел длится от 8 до 17 мс, и состоит из 4–9 непосредственно следующих друг за другом импульсов. Чтобы не пришлось перематывать в начало, повторю здесь картинку (она вроде взята из журнала Science за 2015 год из «одноименной» статьи).

Жук продуцирует внутри себя два «компонента ракетного топлива» (т.е. он все ж такие не «монотопливный»). Сильный восстановитель — гидрохинон (использовался ранее как проявитель в фотографии). И сильный окислитель — перекись водорода. При угрозе жук сокращает мышцы, которые выталкивают два реагента через клапанные трубки в смесительную камеру, содержащую воду и смесь ферментов (пероксидаз) разлагающих перекись. В сочетании, реагенты дают бурную экзотермическую реакцию, жидкость закипает и превращается в газ (= «аннигиляция»). В общем, жук обваривает потенциального врага струей кипятка (но для первой космической тяги явно недостаточно). Но…По крайней мере жука вполне можно считать иллюстрацией к разделу Техника безопасности при работе с перекисью водорода. Мораль следующая:
%USERNAME%, не будь как жук-бомбардир, не смешивай без понимания перекись с восстановителем! :)
Ну вот и про жука рассказал и с перекисью разобрались. На этом пока и остановимся.
Важно! Все остальное (в том числе обсуждение заметок, промежуточные черновики и абсолютно все мои публикации) — можно найти в телеграм-канале LAB66. Подписывайтесь и следите за анонсами.
Следующий в очереди на рассмотрение — дихлоизоцианурат натрия и «хлорные таблетки».
«осмиевый катализатор» для автора (если информация из статьи пригодилась): ===>
