Мухи в холодильнике: криоконсервация эмбрионов плодовой мушки

В кино, литературе и видеоиграх можно часто встретить вариации на тему криогенной заморозки, особенно, если сюжет разворачивается вокруг длительного межпланетного путешествия. Концепция заморозить что-то или кого-то до лучших времен не нова, но за последние годы она стала намного популярнее. Сейчас даже существуют специализированные учреждения, которые могут заморозить человека с неизлечимой болезнью, а потом разморозить его, когда будет изобретено лекарство. Правда, по законам живых людей замораживать нельзя. Успешно разморозить человека, который фактически переступил черту между жизнью и смертью, а потом еще и вылечить его недуг — задача для ученых будущего. Криоконсервация может использоваться не только для людей, но и для других организмов.
Плодовые мушки являются важным модельным организмом во многих отраслях науки, посему ученые из Миннесотского университета (США) разработали методику криоконсервации, позволяющую замораживать эмбрионы дрозофилы. Как работает данная методика, с какими трудностями ученым пришлось столкнуться, и насколько успешна созданная разработка? Ответы на эти вопросы мы найдем в докладе ученых. Поехали.
Основа исследования
Drosophila melanogaster, она же дрозофила или плодовая мушка, является без преувеличения уникальным организмом. Это назойливое насекомое, которое в летние месяцы с радостью становится соседом всех любителей свежих фруктов и овощей, играет важную роль во многих исследованиях.

Томас Морган (1866–1945)
В далеком 1909 году Томас Морган использовал плодовую мушку в качестве модельного организма в своих генетических экспериментах. Модельный организм, как это и предполагает сам термин, используются в качестве моделей в процессе изучения каких-либо процессов или явлений живой природы. Чтобы организм стал модельным, он должен соответствовать ряду требований: ученые должны знать о нем максимум, он должен быть простым в разведении, содержании, а время его развития должно быть минимальным.
Дрозофила подходит по всем этим параметрам и не только. Мушки быстро растут, быстро и массово размножаются, смена поколений также происходит быстро, а их эмбрионы прозрачны, что делает дрозофилу идеальным кандидатом для изучения эмбрионального развития животных.
Использование дрозофилы в качестве модельного организма позволило нам сделать множество важных открытий. Неудивительно, что в разных исследовательских лабораториях по всему миру хранится более 160 000 уникальных генотипов дрозофилы.

Внешний вид Drosophila takahashii.
На данный момент поддержание жизни дрозофил полностью ложится на плечи самих ученых, которые должны периодически переносить взрослых особей к свежему корму, постоянно мониторить условия среды обитания, следить за стерильностью (дабы избежать генетического загрязнения) и т.д. Это крайне трудоемкая задача, требующая немало сотрудников, оборудования и ресурсов.
Криоконсервация, напротив, должна быть гораздо проще и выгоднее, не говоря уже о сохранности самих дрозофил и их генетического материала.
Ранее, как заявляют ученые, уже были попытки разработать метод заморозки дрозофил, который испытывался на диком штамме (Oregon R). Однако разработку свернули из-за ее недостаточной воспроизводимости и сложности.
Если же вернуться ближе к теме исследования, а именно к заморозке эмбрионов дрозофилы, то основными проблемами являются введение криопротекторного агента (CPA от cryoprotectant agent), масштабируемость витрификации*, выживаемость эмбриона в зависимости от возраста и генетический фон, зависящий от штамма.
Витрификация* (стеклование) — переход жидкости в стеклообразное состояние при понижении температуры.Проблема, связанная с CPA, проявляется на этапе дехорионации (Drosophila Egg Dechorionation), так как эмбрион становится непроницаем для криопротекторного агента ввиду воскового слоя и желточной мембраны. Если же CPA все же удастся ввести, то требуются большие скорости заморозки и разморозки для достижения криоконсервации посредством витрификации (стеклования). Однако этот процесс крайне сложно масштабировать, если речь идет о тысячах эмбрионов сразу. Не говоря уже о разнице в генетическом фоне разных штаммов дрозофилы, из-за которой заморозка может по-разному влиять на разные штаммы.
В рассматриваемом нами сегодня труде ученые попытались решить вышеописанные проблемы и достичь успешной криоконсервации эмбрионов разных штаммов дрозофилы.
Результаты исследования
Первый этап заморозки эмбриона это определение того, на какой стадии развития его лучше всего замораживать.

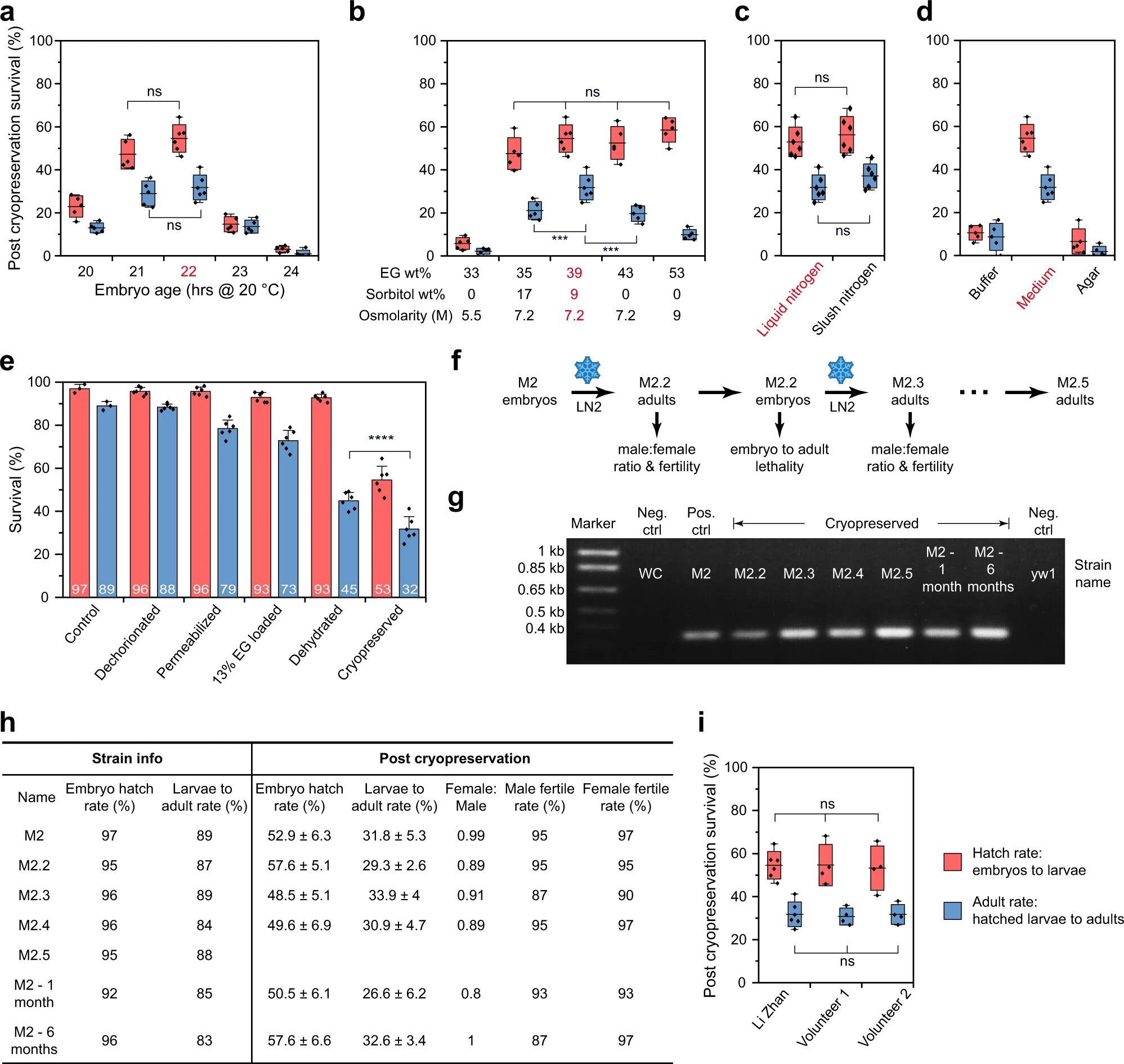
Изображение №1
Для этого использовалась имеющаяся «коллекция» дрозофил, названная М2 (1a). Особи в этой коллекции являются производными от штамма w[1118], а посему обладают прослеживаемым однонуклеотидным полиморфизмом на X-хромосоме и являются гомозиготными, жизнеспособными и фертильными.
Поскольку скорость эмбрионального развития сильно зависит от температуры, необходимо было постоянно мониторить возраст эмбрионов посредством строгого контроля времени инкубации при установленной температуре (например, 20.1 ± 0.05 °C). Также контролировались и морфологические особенности путем изучения внешнего вида кишечника (выглядит, как темные участки) эмбриона под микроскопом (кишечник выделен белыми линиями на 1b). При использовании препарирующего микроскопа кишечник приобретал молочный цвет (ниже на 1b).
С 19-ого по 24-ый час инкубации внешний вид кишечника меняется от структуры в форме сердца (19 часов инкубации) до набора из 3–4 полупараллельных полос, которые лежат перпендикулярно длинной оси эмбриона (20 часов), затем постепенно наклоняется (21–22 часа) и в конечном итоге принимает более вытянутую форму (23–24 часа).
После криоконсервации эмбрионов на разном этапе их развития была выполнена разморозка. Это позволило оценить степень выживаемости эмбрионов по скорости вылупления (от эмбрионов до личинок) и выживаемости взрослых особей (вылупившиеся личинки → окукливание → почти взрослые особи). В результате было установлено, что эмбрионы на 22-ом часу развития обеспечивают самую высокую выживаемость после криоконсервации (2a).
Изображение №2
Дело в том, что у эмбрионов в более старшем возрасте начинает формироваться непроницаемый слой кутикулы, препятствуя поглощение CPA, и поэтому выживаемость резко снижается.
Возраст мошек, используемых для сбора эмбрионов, также повлиял на результат криоконсервации. Выживаемость эмбрионов, полученных от более старых мух (9–12 дней), была значительно ниже, чем от более молодых (1–4 дня).
Далее была выполнена процедура стабилизации проницаемости эмбрионов посредством сетчатой корзины и смеси D-лимонена и гептана (сокращенно LH от D-limonene и heptane). Было установлено, что выдержки эмбрионов в LH растворе в течение 10 секунд вполне достаточно для удаления парафина и повышения проницаемости желточной мембраны, вызывая при этом минимальное повреждение. Далее эмбрионы окрашивались в красный цвет с помощью раствора родамина B, а затем с них удалялся восковой слой (1c).
В результате эмбрионы были полностью проницаемы для CPA, содержащего этиленгликоль (EG), пропиленгликоль (PG) и диметилсульфоксид (DMSO), но не для CPA, содержащего сахариды (сахароза, сортибол и трегалоза).
Чтобы ввести CPA в эмбрионы для последующей витрификации, монослой эмбрионов сначала подвергали воздействию проницаемой CPA с низкой концентрацией (13 мас.%). Более 90% эмбрионов сначала потеряли воду и сжались из-за более высокой внешней осмолярности*, за чем последовало набухание, когда CPA проникал внутрь (1c).
Осмолярность* (осмотическая концентрация) — суммарная концентрация всех растворенных частиц.На следующем этапе было выполнено увеличение внутриэмбриональной концентрации CPA за счет обезвоживания путем помещения эмбрионов в CPA с высокой концентрацией (~ 39 мас.%) при 4 °C. Обезвоженные эмбрионы стали плоские по форме и имели множество складок на поверхности.
Важно и то, что более высокая внутриэмбриональная концентрация CPA приводит к большей защите от летального образования льда во время последующего охлаждения и повторного нагревания, но также может привести к большей токсичности CPA, особенно при температурах выше нуля. Проанализировал выживаемость при различных концентрациях CPA, ученые установили, что 9 минут дегидратации в 39 мас.% этиленгликоля + 9 мас.% сорбита идеально подходит для успешной криоконсервации, так как снижает затраты реагентов и время выполнения самой процедуры.
После завершения всех подготовительных этапов ученые приступили непосредственно к заморозке эмбрионов. Для того чтобы криоконсервацию можно было использовать сразу на большом количестве эмбрионов, был разработан метод «криосетки» — нейлоновая сетка, прикрепленная к тонкому держателю из полистирола. Сетка размером 2×2 см может вместить около 1700 эмбрионов. Для каждого отдельного опытного захода заморозки использовалось от 200 до 600 эмбрионов.
Когда криосетка вдавливается в раствор CPA, в котором плавают эмбрионы, последние переносятся на сетку, а CPA поднимается (1a).
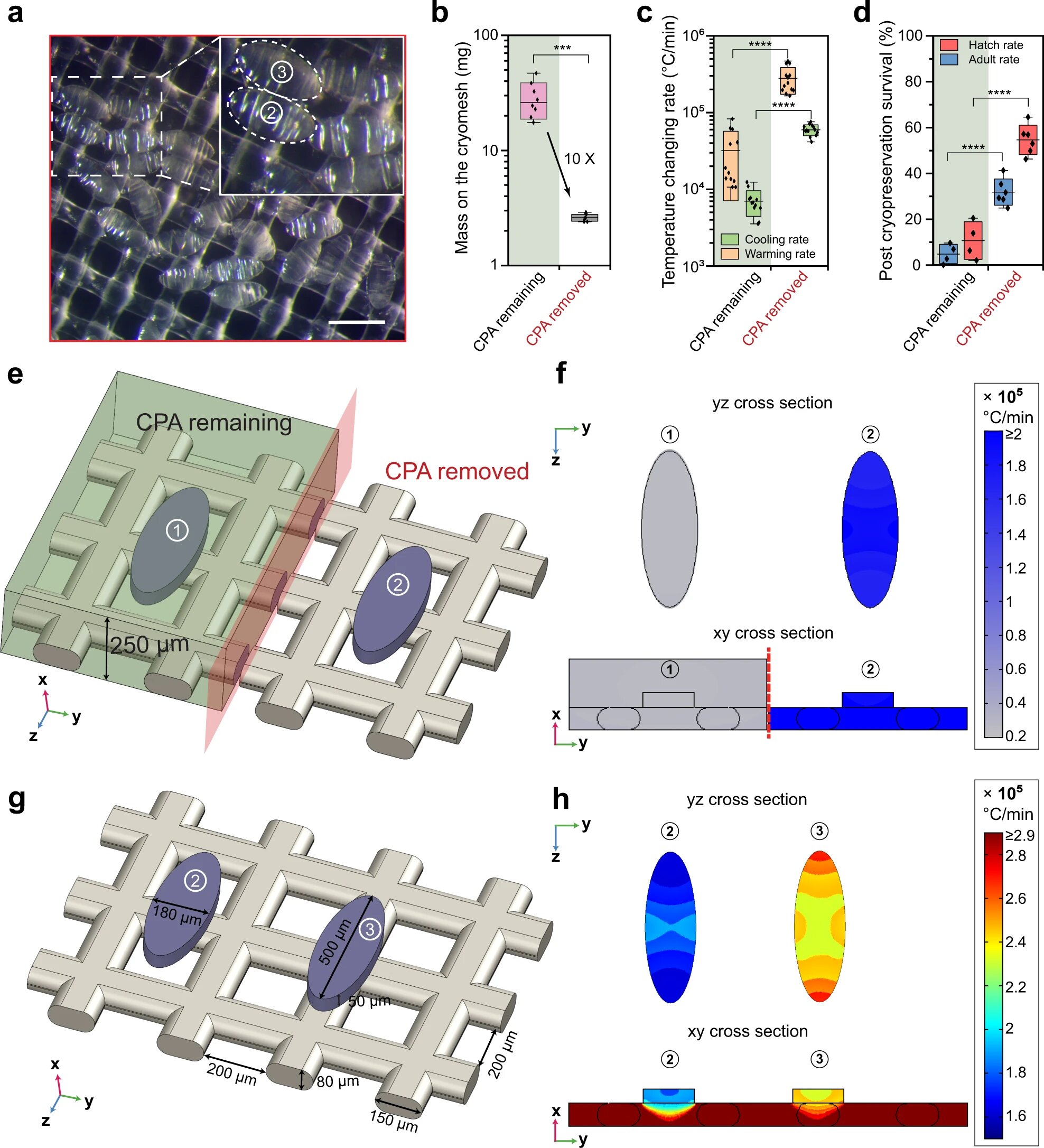
Изображение №3
Ученые отмечают, что удаление излишков раствора CPA с криосетки непосредственно перед стеклованием уменьшило общую массу на криосетке в 10 раз, тем самым повысив скорость охлаждения/нагревания и выживаемость эмбрионов после криоконсервации (3a-3d).
Другими словами, чем меньше лишнего раствора CPA остается на сетке, тем быстрее будет процесс заморозки и тем больше эмбрионов одновременно можно будет стекловать (3c).
Затем криосетку с эмбрионами быстро погружали в жидкий азот (LN2) для стеклования и последующего хранения. Выявить успешность стеклования можно было визуально: витрифицированные эмбрионы становились прозрачными, а кристаллизованные (т.е. стеклование прошло неудачно) становились белыми (1c).
Для сравнения был использован другой хладагент — SN2 (slush nitrogen). SN2 является более молодым вариантом LN2, который применялся в предыдущих исследованиях для стеклования эмбрионов. В рамках данного эксперимента SN2 показал более высокую скорость заморозки, но такую же скорость нагревания, как и LN2. Кроме того, показатели выживаемости в случае использования SN2 практически не отличались от LN2. По этой причине было решено продолжить использовать именно жидкий азот, так как SN2 гораздо сложнее производить (2c).
Факт того, что на криосетке было минимум раствора CPA, играет важную роль и в процессе нагревания. Предыдущие исследования показали, что скорость нагревания крайне важна для выживаемости эмбрионов. Правильное нагревание может даже спасти те эмбрионы, чья заморозка прошла с ошибками (например, образование льда).
Моделирование процесса нагревания показало, что при наличии CPA этот процесс протекает значительно медленнее. К примеру, скорость нагрева падает до 2.4×104 °C/мин при толщине слоя CPA в 250 мкм (2e-2f).
Если же удалить CPA, то моделирование показывает, что увеличение площади контакта эмбрионов с криосеткой увеличивает скорость начала вторичного нагревания, так как нейлоновая секта нагревается быстрее эмбрионов (3g-3h).
После успешного охлаждения и последующего нагревания необходимо было удалить CPA, присутствующий внутри эмбрионов. Для этого эмбрионы после нагревания подвергались воздействию 15 мас.% раствора сахарозы перед криобуфером (т.е. изотоническим солевым буфером*) для смягчения осмотического шока (повреждение /распад клеток).
Изотонический солевой буфер* состоит из хлорида натрия (NaCl), диспергированного в стерильной воде в концентрации, при которой объем остается в пространстве внеклеточной жидкости (ECF от extracellular fluid). Буфер называется изотоническим, так как он не меняет размер клеток.Дополнительно был протестирован метод прямой загрузки эмбрионов в изотонический буфер (т.е. без раствора сахарозы). На удивление скорость вылупления таких эмбрионов была такой же, как и при использовании сахарозы, но выживаемость была ниже. Это, по мнению ученых, связано с желточной мембраной, которая помогает избежать чрезмерного набухания обезвоженных эмбрионов.
Результирующая выживаемость вылупившихся и взрослых особей после криоконсервации составила 52.9 ± 6.3% и 31.8 ± 5.3%, тогда как выживаемость без заморозки составляла 97% и 89%. Полученные результаты могут показаться слишком малыми, однако для такого рода процедур это весьма внушительные цифры.
В заключение ученые проверили эффективность данного метода криоконсервации на других 24 штаммах мошек (графики ниже).
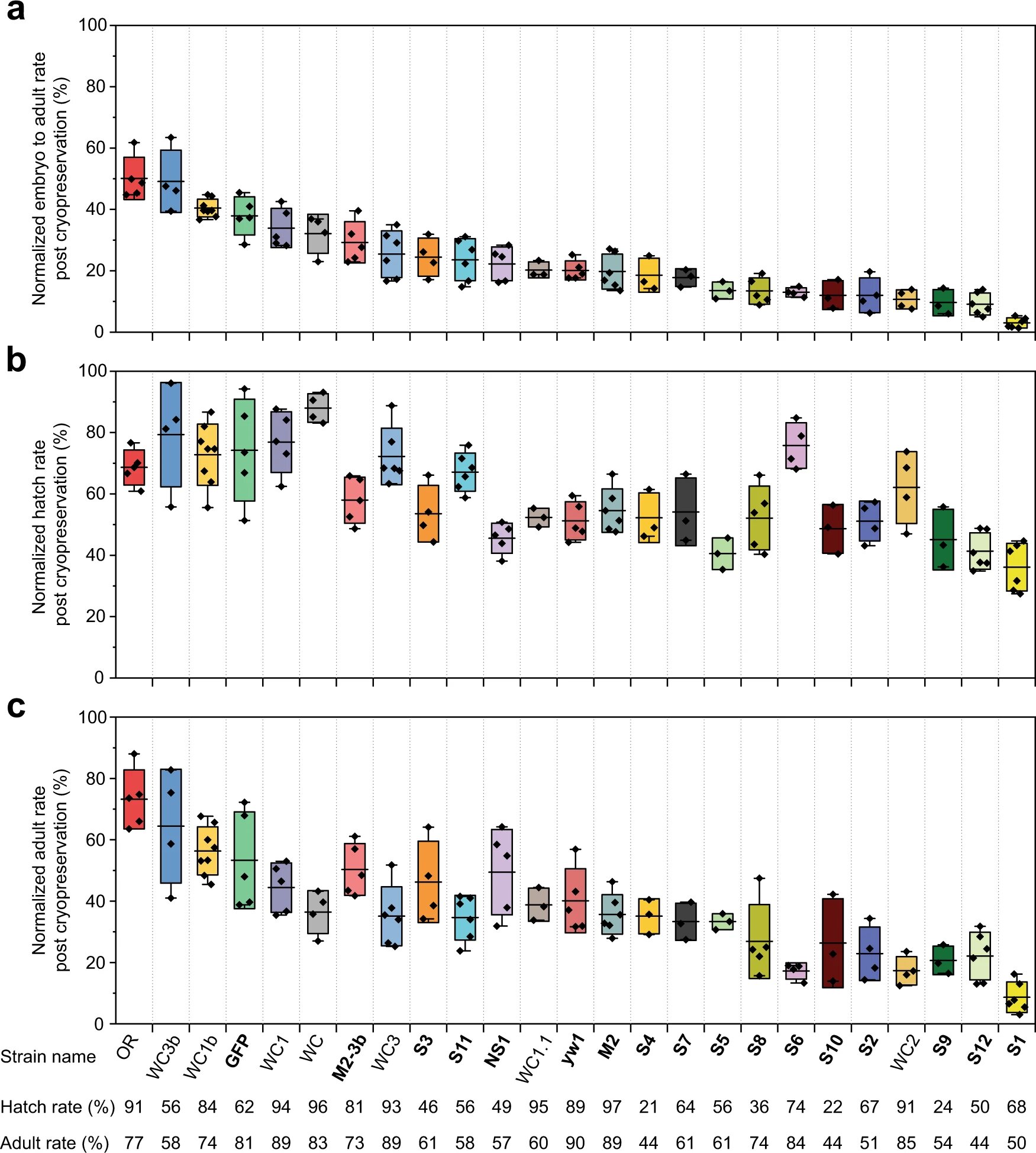
Изображение №4
В результате было установлено, что использованные первоначально условия проведения процедуры заморозки/нагревания одинаково успешны для всех протестированных штаммов, хоть и были некоторые незначительные отличия.
В частности, для штамма S7 21-часовые эмбрионы обеспечивали более высокую выживаемость после криоконсервации, чем 22-часовые эмбрионы, из-за несколько более высокой скорости эмбрионального развития.
Для более детального ознакомления с нюансами исследования рекомендую заглянуть в доклад ученых и дополнительные материалы к нему.
Эпилог
В данном труде ученые продемонстрировали методику криоконсервации эмбрионов дрозофилы. Для достижения максимальной выживаемости эмбрионов после охлаждения/нагревания необходимо было учесть несколько важных аспектов и обойти некоторые трудности. К примеру, важную роль играл не только возраст эмбрионов (оптимальный: 22-ой час развития), которые будут подвержены охлаждению, но и возраст родителей (оптимальный: 1–4 дня). Для успешного введения в эмбрионы криопротекторного агента (CPA) была использована методика увеличения проницаемости, основанная на погружении эмбрионов в смесь D-лимонена и гептана. Эта процедура позволяла снять с них парафиновую оболочку и повысить проницаемость желточной мембраны. Но лишний CPA, остающийся на поверхности эмбрионов, мог бы усложнить процедуру охлаждения, потому его необходимо было удалить. Это было сделано посредством «криосетки» (нейлоновая сетка, прикрепленная к тонкому держателю из полистирола). Очистка эмбрионов от излишков CPA снижала общую массу примерно в 10 раз, тем самым ускоряя процесс заморозки, для которой использовался жидкий азот. А вот удаление CPA из эмбрионов на этапе нагревания происходило за счет погружения последних в раствор сахарозы, что значительно снижало вероятность осмотического шока.
На первый взгляд кажется, что вся эта процедура невероятно сложна. Однако авторы уверяют в обратном. Они даже проверили это, пригласив добровольцев (два старшеклассника), которых обучили проводить криоконсервацию самостоятельно. Новоявленные лаборанты крайне быстро освоились, а выживаемость эмбрионов, с которыми они работали, оставалась на уровне, описанном учеными в их труде.
Несмотря на свои малые габариты, дрозофилы играют крайне важную роль современной науке. Между человеком и дрозофилой много общего, особенно в аспекте генов. Изучение мутантов этого модельного организма позволяет выяснить, как подобного рода генетические изменения могут повлиять на человека, заявляют авторы исследования. Именно потому сохранение взрослых особей и эмбрионов дрозофил для будущих исследований играет столь важную роль.
Благодарю за внимание, оставайтесь любопытствующими и отличных всем выходных, ребята! :)
Немного рекламы
Спасибо, что остаётесь с нами. Вам нравятся наши статьи? Хотите видеть больше интересных материалов? Поддержите нас, оформив заказ или порекомендовав знакомым, облачные VPS для разработчиков от $4.99, уникальный аналог entry-level серверов, который был придуман нами для Вас: Вся правда о VPS (KVM) E5–2697 v3 (6 Cores) 10GB DDR4 480GB SSD 1Gbps от $19 или как правильно делить сервер? (доступны варианты с RAID1 и RAID10, до 24 ядер и до 40GB DDR4).
Dell R730xd в 2 раза дешевле в дата-центре Maincubes Tier IV в Амстердаме? Только у нас 2 х Intel TetraDeca-Core Xeon 2x E5–2697v3 2.6GHz 14C 64GB DDR4 4×960GB SSD 1Gbps 100 ТВ от $199 в Нидерландах! Dell R420 — 2x E5–2430 2.2Ghz 6C 128GB DDR3 2×960GB SSD 1Gbps 100TB — от $99! Читайте о том Как построить инфраструктуру корп. класса c применением серверов Dell R730xd Е5–2650 v4 стоимостью 9000 евро за копейки?
