Метаболический топливный элемент на основе глюкозы в крови для самодостаточной биоэлектроники
Авторы: Дебасис Майти, Прит Гуха Рэй, Peter Buchmann, Майсам Мансури, Мартин Фуссенеггер
https://doi.org/10.1002/adma.202300890
Аннотация
Доступные в настоящее время биоэлектронные устройства потребляют слишком много энергии, чтобы их можно было непрерывно использовать от перезаряжаемых батарей, и часто питаются по беспроводной сети, что приводит к проблемам с надежностью, удобством и мобильностью. Таким образом, наличие надежного, самодостаточного, имплантируемого генератора электроэнергии, который работает в физиологических условиях, будет трансформирующим для многих применений, от управления биоэлектронными имплантатами и протезами до программирования клеточного поведения и метаболизма пациентов. Здесь, используя новый медьсодержащий композит из 3D углеродных нанотрубок с регулируемой проводимостью, разработан имплантируемый метаболический топливный элемент, работающий на глюкозе в крови, который непрерывно контролирует уровень глюкозы в крови, преобразует избыток глюкозы в электроэнергию во время гипергликемии и вырабатывает достаточно энергии (0,7 МВт см-2, 0,9 В, 50 мm глюкозы) для опто- и электрогенетической регуляции выделения везикулярного инсулина из сконструированных бета-клеток. Показано, что эта интеграция мониторинга уровня глюкозы в крови с устранением избыточного уровня глюкозы в крови путем комбинированного электрометаболического преобразования и потребления клеток, опосредованного высвобождением инсулина, позволяет метаболическому топливному элементу восстанавливать гомеостаз глюкозы в крови автоматическим, самодостаточным и замкнутым способом в экспериментальной модели диабета 1 типа.
1 Введение
Взаимосвязанные интеллектуальные электронные устройства все чаще доминируют в нашей повседневной жизни и формируют новые возможности в биомедицинских науках.[1, 2] В то время как современные электронные носимые устройства в основном собирают и обрабатывают основные физические параметры и данные о состоянии здоровья,[3–5] передовые исследования в области биоэлектроники показали, что молекулярные интерфейсы между клетками и электроникой в принципе могут быть встроены в биоэлектронные имплантаты, которые координируют мониторинг биомаркеров и информацию обработка с производством и высвобождением белковых терапевтических средств сконструированными клетками.[6–8] Совместимость между биологическими и электронными системами была достигнута благодаря недавним достижениям в синтетической биологии, которые создали программируемые генетические схемы, способные реализовывать электронные принципы управления и обработки,[9], такие как генераторы,[10–12] аналого-цифровые преобразователи,[13] и полу- и полные сумматоры.[14, 15] Это позволил разработать биоэлектронные интерфейсы, программирующие поведение клеток с помощью бесследных физических сигналов, питаемых электричеством, [16], включая свет,[3, 6, 17, 18] магнитные поля,[19] тепло,[20] и прямые электрические поля.[7, 21]
Стимуляция сконструированных клеток светом,[17] или электрическими полями,[7, 21], которые взаимодействуют с каскадами синтетической сигнализации, контролирующими деполяризацию клеточных мембран, особенно привлекательна для биомедицинских применений, поскольку такие системы могут запускать быстрое высвобождение биофармацевтических препаратов в пузырьках в течение нескольких минут. Это важно для лечения таких заболеваний, как диабет 1 типа, которые требуют сложного динамического контроля.[22–24] Электростимулированное быстрое высвобождение везикул достигается либо путем активации рекомбинантного меланопсина сетчатки синим светом,[17, 22] или путем сенсибилизации клеток к электрическим полям путем совместной экспрессии управляемого напряжением канала L-типа CaV1.2 и выпрямляющего калиевый канал Kir2.1 в клетках человека.[7]
Однако, доступные в настоящее время биоэлектроника и биоэлектронные имплантаты, в частности, основанные на оптогенетике, потребляют слишком много энергии, чтобы непрерывно работать от перезаряжаемых батарей. Они должны получать беспроводное питание от генераторов экстракорпорального поля, подключенных к розетке, что ограничивает безопасность, удобство и мобильность.[6, 7, 21, 25] Поэтому будущее развитие биоэлектроники и биоэлектронных имплантатов будет зависеть от наличия надежного, самодостаточного, имплантируемого генератора электрической энергии.
Циркулирующие в организме жидкости содержат множество высокоэнергетических метаболитов, которые в принципе могут быть использованы для непрерывного производства электроэнергии, необходимой для самодостаточной работы биоэлектроники. Особенно перспективным субстратом, по-видимому, является глюкоза в крови, всплески которой после приема пищи могут быть доступны для электрометаболического преобразования. Хроническая гипергликемия, связанная с сахарным диабетом, поражает более десяти процентов населения земного шара,[26] и, следовательно, может обеспечить постоянный источник электроэнергии для биоэлектроники. Кроме того, непрерывное рассеивание избыточной метаболической энергии путем электрометаболического преобразования также может помочь в восстановлении гомеостаза глюкозы в крови.
Биотопливные элементы первого поколения, использующие глюкозу, основанные на очищенной глюкозооксидазе, действительно установили общий принцип электрометаболического преобразования,[27–31] Однако низкая выходная мощность, ограниченный перенос электронов, низкий срок годности / полураспада фермента и биообрастание имплантированных электродов пока имеют ограниченное применение в реальном мире.[32] Эффективность переноса электронов и проводимость были значительно улучшены путем конъюгации глюкозооксидазы с одномерными наноматериалами, такими как графен или многостенные углеродные нанотрубки (MWCNTS),[33], но тот факт, что эти биотопливные элементы потребляли кислород, что способствует гипоксии и коррозии электродов, делает их бесполезными для клинического применения.[34, 35] Замена глюкозооксидазы электроактивными оксидами металлов, такими как оксид меди (CuO), внедренными в 1- или 2D углеродные нанокомпозиты, действительно улучшила стабильность, срок годности и долговременную производительность, но из-за более низкой скорости переноса электронов при электрокатализе глюкозы плотность мощности этих неферментативных элементов на биотопливе глюкозы недостаточна для управления биоэлектронными имплантатами.[36] Кроме того, использование отдельно стоящих композитов и отсутствие биосовместимого матричного материала для электродов до сих пор препятствовали разработке клинических применений неферментативных клеток на биотопливе.[33, 37–39] Однако гибридные ферментативные биотопливные элементы недавно показали многообещающую производительность. Например, производство биотопливных элементов на основе металлических хлопковых волокон, покрытых глюкозооксидазой (GOx), или углеродной ткани с содержанием GOx (CC), обеспечивало плотность мощности (PD) 3,7 МВт / см -2 и 1,07 МВт/ см-2 в 300 м м и 100 мм растворе глюкозы соответственно.[40, 41] Кроме того, GOx также наносили на сшитые УНТ для достижения PD 0,94 МВт/ см-2 в 200 мм растворе глюкозы при насыщении O2.[42] В параллельном исследовании загруженный GOx органический металлический композит на основе CNT-Ag / нафталинтиола обеспечивал выходную мощность 1,46 МВт / см-2 в присутствии 400 мм глюкозы.[43] Тем не менее, эти ферментативные биотопливные элементы работают только при концентрации глюкозы 100 мм или выше, что значительно выше физиологической концентрации глюкозы даже при диабете.
Чтобы преодолеть эти проблемы, мы разработали иерархически оформленную трехмерную матрицу из CuO-MWCNTs и композита поли (3,4-этилендиокситиофен)-поли (стиролсульфонат) (PEDOT: PSS) (CuO-MWCNTs-PEDOT: PSS) и изготовили метаболический топливный элемент без медиаторов, который постоянно контролирует уровень глюкозы в крови, вырабатывает электричество исключительно во время гипергликемии и вырабатывает достаточно электроэнергии для питания и управления биоэлектронными имплантатами на основе оптогенетических и электрогенетических технологий. Программируя эти биоэлектронные имплантаты для быстрого высвобождения инсулина из сконструированных клеток человека с использованием оптогенетических или электрогенетических интерфейсов, мы создали системы метаболического контроля с замкнутым контуром, которые могут автономно восстанавливать гомеостаз глюкозы при экспериментальном диабете 1 типа.
2 Результат

Концепция метаболического топливного элемента
Мы разработали имплантируемый метаболический топливный элемент, который подключается к энергетическому метаболизму млекопитающих, катализируя превращение избыточной глюкозы в крови в неинсулиногенный глюконат, секретируемый почками, высвобождая электрон и преобразуя метаболическую энергию в электрическую энергию (рисунок 1). Схема управления электрическим питанием постоянно контролирует уровень глюкозы в крови и подключает метаболический топливный элемент к носимым и мобильным устройствам для связи, записи и внешней настройки. Его маломощное зарядное устройство и конденсатор, заряжаемые во время гипергликемии, обеспечивают более 4 вольт, что достаточно для обеспечения электрогенетического и оптогенетического контроля производства биофармацевтических препаратов с помощью имплантированных инженерных клеток человека (рисунок 1). Подключение метаболического топливного элемента к электро- или оптогенетической выработке инсулина с помощью сконструированных клеток человека создает замкнутую схему управления, в которой метаболический топливный элемент включается во время гипергликемии и запускает электро- или оптогенетическое быстрое высвобождение инсулина. Комбинированный эффект потребления глюкозы метаболическим топливным элементом и поглощения глюкозы клетками, опосредованного высвобождением инсулина, восстанавливает гомеостаз глюкозы в крови, который отключает метаболический топливный элемент для предотвращения гипогликемии (рисунок 1). Поскольку уровень глюкозы в крови сам регулирует накопление заряда метаболического топливного элемента, контроль диабета достигается полностью автономным, самодостаточным и бесперебойным образом (рисунок 1).
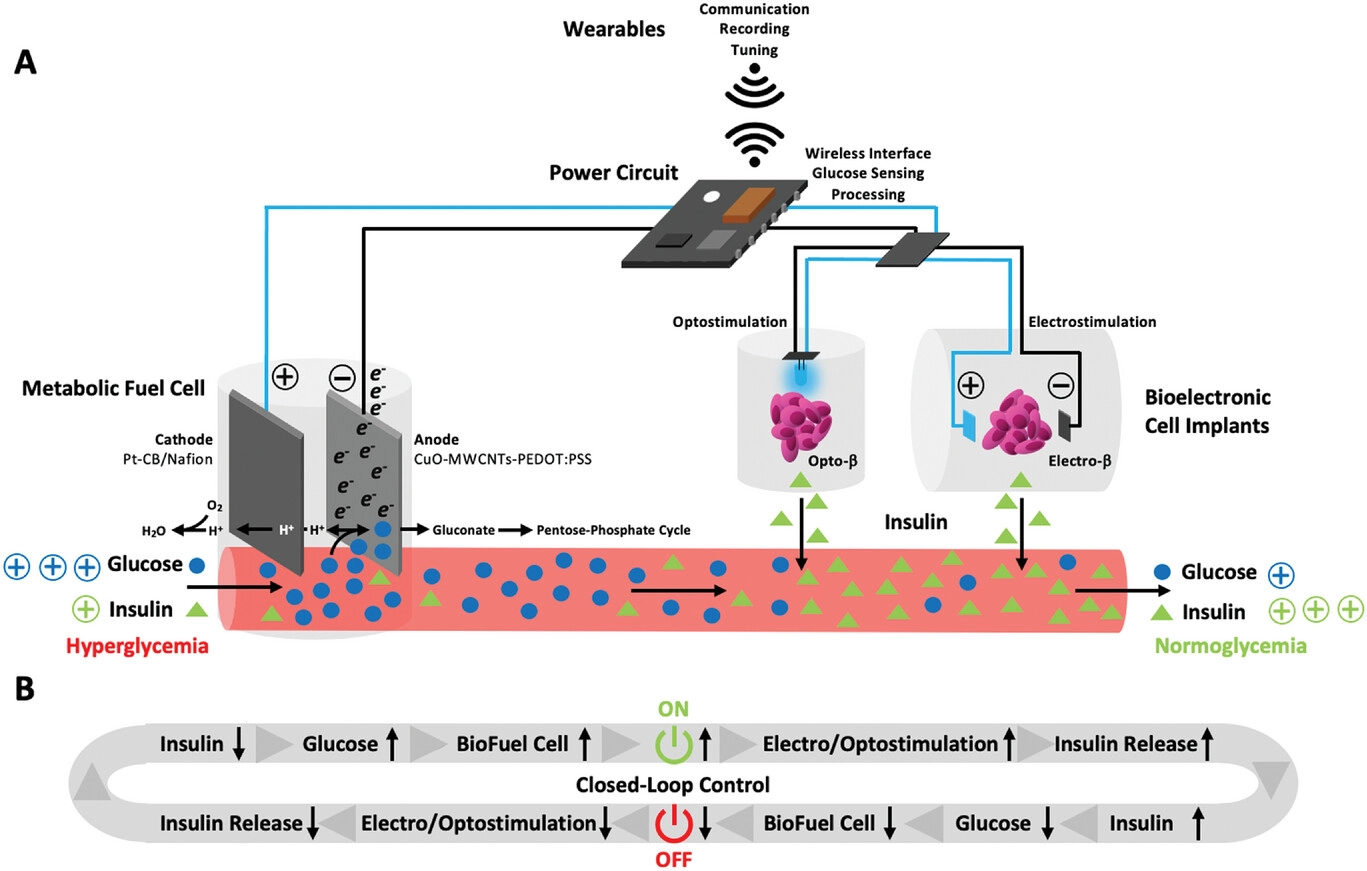
Рисунок 1 Схема неферментативного метаболического топливного элемента для управления гомеостазом глюкозы в крови по замкнутому циклу. А) Работа метаболического топливного элемента. После имплантации метаболический топливный элемент подключается к кровотоку. На аноде, состоящем из наночастиц оксида меди (CuO), встроенных в многостенные углеродные нанотрубки (MWCNTs) и покрытых поли- (3,4-этилендиокситиофен)-поли (стиролсульфонатом) (PEDOT: PSS) (CuO-MWCNTs-PEDOT: PSS), глюкоза каталитически превращается в глюконат с сопутствующим образованием протоны (H+) и электроны (e-). В то время как глюконат либо выводится почками, либо поступает в пентозофосфатный цикл, электронная схема снабжается электронами, а протоны направляются к катоду, состоящему из наночастиц платины (Pt-CB/ Nafion), содержащих углеродную сажу (CB), покрытую нафионом, где они восстанавливают кислород до воды (H2O). Электроны поступают в силовую цепь, которая обеспечивает беспроводной интерфейс с носимыми устройствами для связи, записи и настройки, управляет определением уровня глюкозы и обрабатывает работу метаболического топливного элемента при уровнях глюкозы в крови выше 10 м м глюкозы. Используемая электрическая энергия используется для стимулирования инженерных клеток человека к выделению терапевтических белков, таких как инсулин, в ответ на свет (оптостимуляция опто-β-клеток) или электрические поля (электростимуляция электро-β-клеток). Б) Гомеостаз глюкозы в крови с замкнутым циклом. Схема питания метаболического топливного элемента постоянно контролирует уровень глюкозы в крови и включает метаболический топливный элемент, когда уровень глюкозы в крови превышает 10 м м. Метаболический топливный элемент не только снижает уровень глюкозы в крови за счет потребления глюкозы, но также использует полученную энергию для электро- или оптостимуляции быстрого выделения везикулярного инсулина сконструированными клетками человека. Комбинация этих действий снижает уровень глюкозы в крови до нормального уровня, и метаболический топливный элемент отключается. Как следствие, электро- и оптостимуляция прекращается, как и выделение инсулина, что дает время для пополнения запасов инсулина до следующего скачка уровня глюкозы. Метаболический топливный элемент и клетки-конструкторы человека образуют замкнутую схему управления, которая поддерживает гомеостаз глюкозы в крови автоматическим, бесперебойным и самодостаточным образом.
В метаболическом топливном элементе используются гибкие соединенные электроды, собранные путем 3D-монолитного объединения различных наноматериалов. Анод состоит из гибкого графитового войлока, обеспечивающего 3D-поддержку пространственно оформленного комплекса CuO-MWCNTs-PEDOT: PSS. В то время как переход CuO из Cu (II) в Cu (III) катализирует окисление глюкозы в глюконат, многостенные углеродные нанотрубки захватывают, удаляют и транспортируют полученный электрон, поддерживаемый проводящим наполнителем, PEDOT: PSS (рисунки 1, 2A). Катод состоит из гибкого CC, обеспечивающего 3D-поддержку наночастиц платины, декорированных сажей (CB) (PtNP), которые покрыты нафионом для максимального и селективного использования протонов при окислении глюкозы в глюконат на основе анода, что позволяет катализируемой платиной реакции протонов с кислородом с образованием H2O, таким образом, замыкая электрический цикл метаболического топливного элемента (рисунки 1, 3A). ).
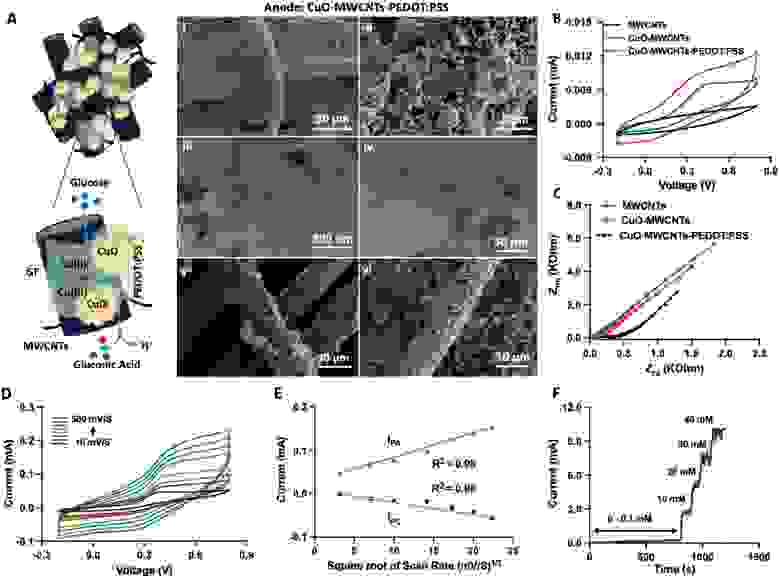
Рисунок 2 Анод неферментативного метаболического топливного элемента. А) Схема нанокомпозитного анодного материала, состоящего из наночастиц оксида меди (CuO), многостенных углеродных нанотрубок (MWCNTs) и поли (3,4-этилендиокситиофен)-поли (стиролсульфоната) (PEDOT: PSS), иммобилизованных на графитовом войлоке (GF). Окислительно−восстановительный переход меди катализирует превращение глюкозы в глюконовую кислоту и протон (H+), высвобождая при этом один электрон (e-). i, ii) Сканирующие электронные эмиссии (FESEM) и iii, iv) просвечивающие электронные (TEM) микрофотографии CuO / MWCNTs / PEDOT: материал анода, модифицированный PSS / графитовым войлоком, через v) 1 день и vi) 60 дней (только для FESEM). Б) Циклическая вольтамперометрия и В) спектроскопия импеданса MWCNTs, CuO / MWCNTs и CuO / MWCNTs /PEDOT: электроды PSS. Циклическая вольтамперометрия CuO/MWCNTs/PEDOT: аноды PSS с разной скоростью сканирования (10, 50, 100, 200, 300, 400, 500 мВ с-1) в присутствии D) 10 мм глюкозы и E) соответствующей корреляции между током и скоростями сканирования. F) Стационарное амперометрическое профилирование CuO / MWCNTs / PEDOT: каталитическое окисление глюкозы PSS при 0,50 В с последовательным добавлением глюкозы.
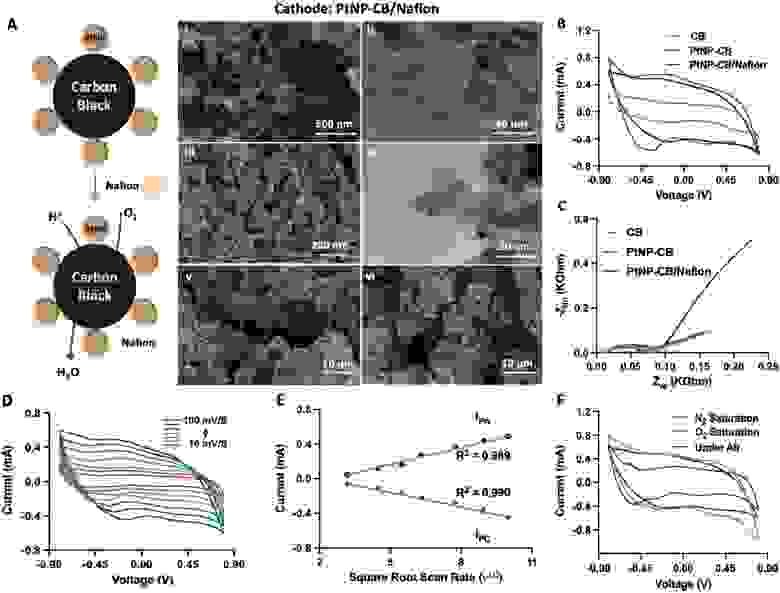
Рисунок 3 Катод неферментативного метаболического топливного элемента. А) Схема нанокомпозитного катодного материала, состоящего из наночастиц платины (PtNP), содержащих сажу, покрытую нафионом (CB). PTNPS катализируют восстановление протонов (H+) и кислорода (O 2) до воды (H2O). i, ii) Сканирующие электронные эмиссии (FESEM) и iii, iv) просвечивающие электронные (TEM) микрофотографии катодного материала, модифицированного углеродной сажей, покрытого наночастицами платины (PtNP-CB / Nafion), через v) 1 день и vi) 60 дней (только для FESEM). Б) Циклическая вольтамперометрия и В) импедансная спектроскопия электродов, модифицированных сажей (CB), PtNP-CB и PtNP-CB с нафионовым покрытием и модифицированных Nafion. Циклическая вольтамперометрия PtNP-CB катодов с покрытием Nafion с D) различной скоростью сканирования (10, 20, 30, 40, 60, 80, и 100 мВ с-1) и E) корреляция между скоростью тока и сканирования. F) Циклическая вольтамперометрия покрытых нафионом PtNP-CB катодов, насыщенных воздухом, газообразным азотом (N2) и кислородом (O2) в фосфатно-буферном физиологическом растворе (PBS).
Характеристика и валидация анода
Морфологический анализ анода с помощью полевой эмиссионной сканирующей электронной микроскопии (FESEM) (рис. 2A-i, ii) и просвечивающей электронной микроскопии (TEM) подтвердил трехмерную структуру, состоящую из MWCNTs (шириной≈30 нм), гомогенно покрытых мелкими агрегатами наночастиц CuO (диаметром≈50–150 нм) и заполненных проводящим PEDOT: PSS (рис. 2A-iii, iv). Π–π взаимодействия между MWCNTs и PEDOT: PSS используют электроны от CuO-опосредованного превращения глюкозы в глюконат и улучшают передачу заряда через весь анод к катоду без необходимости в каком-либо посреднике (рисунок 2A-iv). Анод был стабильным с течением времени, и никаких изменений в морфологии 3D нанокомпозита не наблюдалось даже после 60 дней непрерывного использования, что свидетельствует о том, что материал достаточно прочный при работе в имплантируемом метаболическом топливном элементе (рисунок 2A-v, vi).). Пики рентгеновской дифракции соответствуют пикам стандартной моноклинно-фазовой структуры оксида меди (CuO) (карточка JCPDS № 48–1548) (рисунок S1, вспомогательная информация).
Электрохимическая характеристика анодного нанокомпозита показала четкий набор окислительно-восстановительных пиков для CuO-MWCNTs и CuO-MWCNTs-PEDOT: PSS; эти пики отсутствовали в первичных MWCNTs, что указывает на то, что наночастицы CuO действительно генерируют окислительно-восстановительный потенциал (рисунок 2B).). Кроме того, графики импеданса Найквиста, проанализированные с помощью модифицированной эквивалентной схемы Рэндла, показали, что CuO сдерживает передачу электронов в MWCNT, поскольку сопротивление переносу заряда (Rct) исключительно увеличивалось, когда MWCNT были украшены наночастицами CuO (CuO-MWCNT) (рисунок 2C).). Этот эффект был компенсирован за счет проводящего наполнителя PEDOT: PSS, который существенно уменьшил общую Rct анодного нанокомпозита CuO-MWCNTs-PEDOT: PSS (рисунок 2C; Рисунок S2, вспомогательная информация). Пиковый ток увеличивался с более высокими скоростями сканирования, а анодный пиковый (IПА) и катодный пиковый (IПК) токи были прямо пропорциональны квадратному корню из скорости сканирования, что указывает на то, что глюкоза свободно диффундирует по всему метаболическому топливному элементу (рисунок 2D, E).
Амперометрическое измерение уровня глюкозы подтвердило, что анодный нанокомпозит обладает высокой чувствительностью к глюкозе и полностью работоспособен в диапазоне физиологического уровня глюкозы в крови человека от 5 м м до 50 м м (Рисунок 2F; Рисунок S3, вспомогательная информация).
Характеристика и валидация катода
Катод метаболических топливных элементов был изготовлен путем химического осаждения PtNP на поверхность из углеродной сажи (CB) с последующим равномерным покрытием Nafion (рисунок 3A).). Нафионовое покрытие электрода PtNP-CB обеспечивает исключительный перенос протонов к катоду, где они вступают в реакцию с PtNP в присутствии кислорода с образованием H2O. Кроме того, Nafion эффективно защищает электрод от загрязнения, что обеспечивает непрерывное использование, увеличивает срок службы и делает метаболический топливный элемент биосовместимым для имплантации. Обычные платиновые катоды, используемые для классических биотопливных элементов на основе ферментов, окисляются в присутствии радикалов ОН-, что приводит к созреванию по Оствальду и загрязнению электрода, что резко сокращает срок службы и препятствует непрерывной работе имплантата.[40]
Морфологический анализ катода с помощью полевой эмиссионной сканирующей микроскопии (FESEM) и просвечивающей электронной микроскопии (TEM) подтвердил трехмерную структуру катодного нанокомпозита (рисунок 3A), в частности отчетливое и равномерное оформление PtNP (рисунок 3A-i, ii) (диаметром 2–5 нм) на поверхности CB (ширинойоколо100 нм), а также однородную поверхность Nafion и покрытия пересечения PtNP-CB (рисунок 3A-iii, iv). Катод был стабильным в течение по меньшей мере 60 дней без видимых морфологических изменений 3D нанокомпозита, что указывает на то, что материал достаточно прочный для работы в имплантируемом метаболическом топливном элементе (рисунок 3A-v, vi).). Важно отметить, что Nafion увеличивает силу сцепления между PtNP и CB, а также повышает долговечность катода за счет повышения потенциала восстановления кислорода, тем самым защищая метаболический топливный элемент от биообрастания в жидкостях организма.
Циклическая вольтамперометрия (CV) катода показала, что Nafion снижает скорость переноса электронов, и что PtNP-покрытие нанокомпозита PtNP-CB компенсирует этот эффект (рисунок 3B). Аналогичным образом, измерения импеданса подтвердили, что PtNP компенсировал снижение сопротивления передаче заряда (Rct), вызванное слоем нафиона (рисунок 3C; Рисунок S2, вспомогательная информация). Нафион не только служит протоноселективной мембраной катода, он также существенно увеличивает общую производительность, срок годности и долговечность метаболического топливного элемента (рисунок 3A-v, vi). Измерения циклической вольтамперометрии (CV) подтвердили, что токи катодного пика (IПК) и анодного пика (IПА) были линейно связаны с квадратным корнем из скорости сканирования (рисунок 3D), что указывает на свободную диффузию глюкозы по всему метаболическому топливному элементу (рисунок 3E). Циклическая вольтамперометрия (CV) также подтвердила способность катода эффективно переносить электроны для преобразования протонов и кислорода в H2O (рисунок 3F).
Производительность метаболического топливного элемента
Сборка анода и катода обеспечила метаболический топливный элемент, который можно было подключить к энергетической системе млекопитающих для эффективной выработки электроэнергии в пределах физиологического диапазона уровня глюкозы в крови 4–50 м м (рисунок 4A-D). Действительно, базовый метаболический топливный элемент показал увеличение PD и напряжения разомкнутой цепи (OCV) с увеличением уровня глюкозы в крови (рисунок 4A-D), что соответствует или превосходит производительность обычных нефизиологических биотопливных элементов, которые, что критически важно, не являются ни биосовместимыми, ни имплантируемыми. Аналогично, общая плотность тока (CD, мА см-2) также значительно увеличивается в условиях гипергликемии (рисунок 4C). Таким образом, в принципе, метаболический топливный элемент должен быть способен генерировать достаточное количество электрической энергии (0,45 МВт см-2 (PD), 0,6 В (OCV) или 3,6 мА см-2 (CD)) из глюкозы в крови (10 мм) для питания кардиостимуляторов (~ 10–20 мкВт),[44] или для освещения светодиодов для оптогенетики (~ 4,6 мкВт).[ 45]
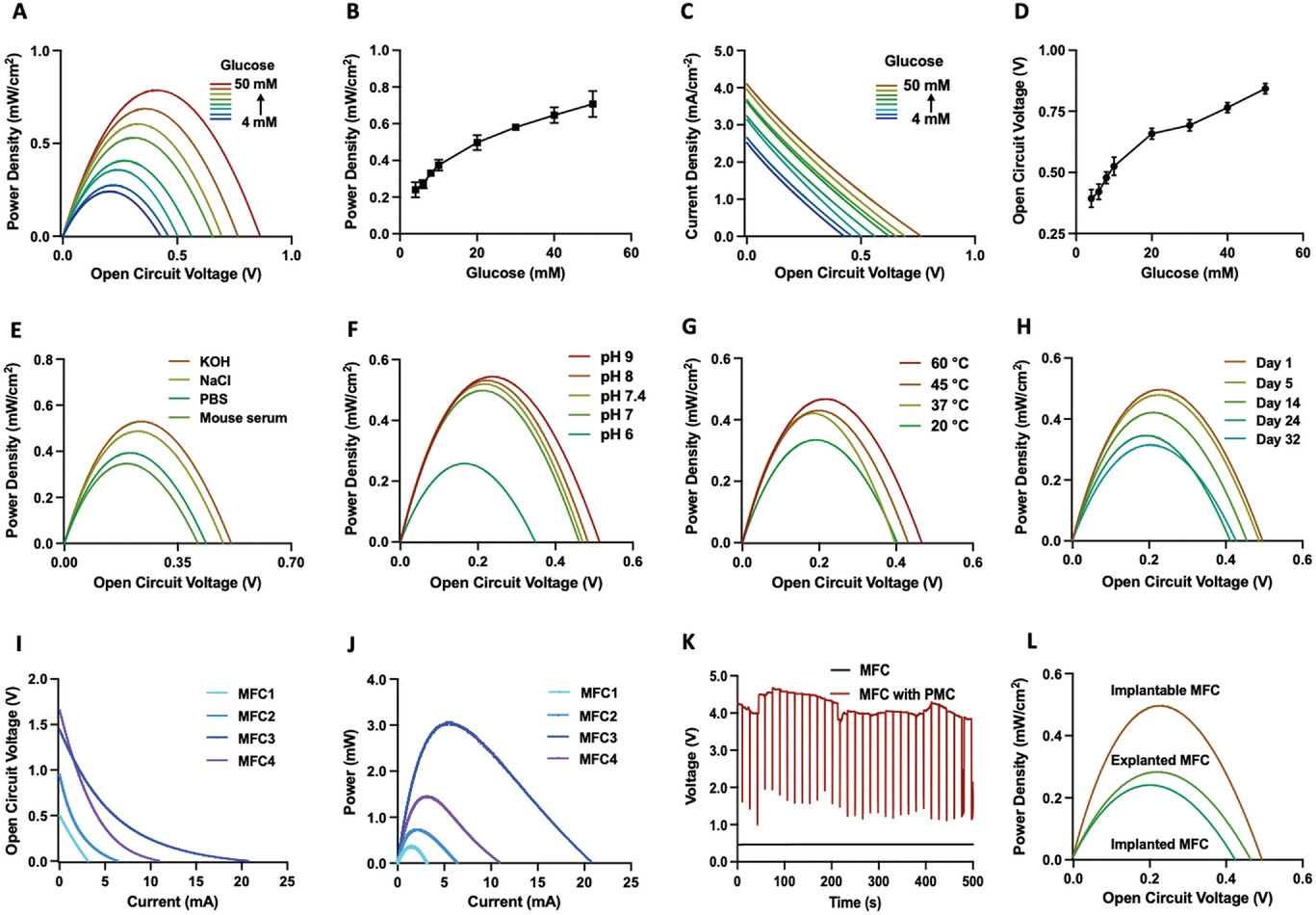
Рисунок 4 Характеристика и анализ производительности метаболического топливного элемента (MFC). А) Плотность мощности, Б) зависящая от глюкозы плотность мощности, В) поляризационные кривые (4, 6, 8, 10, 20, 30, 40, 50 mm глюкоза) и D) напряжение разомкнутой цепи для различных концентраций глюкозы. Плотность мощности МФК, зарегистрированных в присутствии 10 мм глюкозы в различных условиях: E) N2-очищенные растворы (PBS, мышиная сыворотка, NaCl и KOH; 0,1 м, 37 °C), F) N2-очищенные 0,1 м PBS при различных значениях pH (pH 9.8, 7.4, 7, 6; 37 ° C), G) N 2-очищенный KOH при различных температурах (20 ° C, 30 ° C, 40 ° C, 50 ° C; 0,1 m, 37 ° C) и H) в течение различных периодов времени (1, 5, 14, 24, 32 дней, 0,1 м КОН, 37 °C). I) Вольтамперометрическая поляризация с линейной разверткой и J) кривая мощности для различных параллельно и последовательно соединенных МФУ (MFC1 = 1 последовательно подключенный МФУ, MFC2 = 2 последовательно подключенных МФУ, MFC 3 = 4 последовательно и 2 параллельно подключенных МФУ, MFC 4 = 4 последовательно подключенных МФУ). K) Профилирование напряжения разомкнутой цепи одного MFC со схемой управления питанием (PMC). L) Плотности мощности одного имплантируемого MFC in vitro, имплантированного MFC мыши и MFC, эксплантированного через семь дней.
Помимо использования глюкозы в крови в диапазоне физиологических концентраций в качестве источника метаболической энергии, имплантированный метаболический топливный элемент должен работать в сложной тканевой среде со строго контролируемыми физическими (температура тела 37 ° C) и химическими параметрами (ионная проводимость жидкостей организма, таких как сыворотка, рН 7,4). Действительно, мы обнаружили, что метаболический топливный элемент вырабатывал достаточную энергию при 10 м м глюкозы (рисунок 4E–H) в ионных жидкостях организма (рисунок 4E), а также при физиологическом рН (рисунок 4F) и температуре (рисунок 4G), для загрузки — запустите усилитель малой мощности с одновременным усилением выходного сигнала. Производительность, стабильность и надежность метаболического топливного элемента оценивались в течение месяца непрерывного использования в физиологических условиях (10 м м глюкозы, 37 ° C, pH 7,4) (рисунок 4H), в течение которого устройство поддерживало до 70% своей первоначальной производительности. Кроме того, производительность может быть восстановлена до 93% простым мытьем и нагревом устройства, что указывает на то, что его можно будет использовать повторно (рисунок S4, вспомогательная информация). Учитывая, что реальные биомедицинские приложения потребовали бы прерывистой работы, а не непрерывного использования, можно ожидать, что практический срок службы будет еще больше.
Управление напряжением метаболических топливных элементов
Чтобы максимизировать программируемую выходную мощность для различных применений, метаболические топливные элементы могут быть либо расположены последовательно и / или параллельно, либо оснащены схемой управления питанием, содержащей усилитель малой мощности, подключенный к конденсатору (таблица S1, вспомогательная информация),[46, 47].Поэтому мы соединили базовые метаболические топливные элементы в различных конфигурациях (два или четыре последовательно, два последовательно и два параллельно) и профилировали OCV, а также общий CD в присутствии 10 мм глюкозы (рисунок 4I, J). В то время как конфигурация с четырьмя последовательно расположенными элементами обеспечивала самое высокое напряжение OCV (1,65 В; Рисунок 4I; Таблица S1, вспомогательная информация) и непрерывно поддерживали 95% этого значения в течение более 30 часов (рисунок S5, вспомогательная информация), четыре последовательно расположенных в двух параллельных конфигурациях обеспечивали наибольшее общее количество CD (20,71 млн см-2, рисунок 4J; Таблица S1, вспомогательная информация). Параметры производительности всех протестированных конфигураций метаболических топливных элементов выгодно отличаются от описанных неферментативных биотопливных элементов на глюкозе и, по-видимому, хорошо подходят для питания биоэлектронных устройств (таблица S1, вспомогательная информация).). Однако, поскольку имплантаты, сочетающие в себе несколько метаболических топливных элементов, слишком велики для реального клинического применения, мы подключили один метаболический топливный элемент к схеме управления питанием, состоящей из маломощного зарядного устройства, собирающего вырабатываемую глюкозой электроэнергию исключительно во время гипергликемии, и заряжающего конденсатор (330 мкФ), обеспечивающий пиковое напряжение более 4 Вольт (рисунок 4K; Рисунок S6, вспомогательная информация).
Характеристика имплантированных метаболических топливных элементов In Vivo
Чтобы проверить базовый метаболический топливный элемент in vivo, мы имплантировали устройство мышам с диабетом 1 типа и профилировали полученный OCV (0,42 В) (рисунок 4L).). В то время как метаболический топливный элемент генерировал только половину своего PD in vitro при имплантации, OCV снизился всего на 15% (рисунок 4L). Снижение производительности имплантированных метаболических топливных элементов может быть связано с более низкой ионной проводимостью в ткани, а также с возможными помехами из-за фиброза. Однако общая мощность 0,241 МВт/см -2 является самой высокой на сегодняшний день для имплантированного неферментативного метаболического топливного элемента. При эксплантировании и восстановлении путем промывки производительность метаболических топливных элементов увеличилась более чем на 100% по сравнению с эксплуатацией in vivo, что подчеркивает стабильность, надежность и долговечность устройства (рисунок 4L). Чтобы подготовить метаболический топливный элемент для терапевтических применений in vivo и улучшить его биосовместимость, мы покрыли его глубоким слоем альгината, лицензированного FDA. Это существенно не изменило его ключевые показатели производительности (рисунок S7, вспомогательная информация).
