Генная терапия старения vs фармакология
Статья не является медицинской рекомендацией. Цель её рассказать о состоянии дел в отрасли. Автор: Дмитрий Веремеенко. Также мы ищем соавторов для наиболее полного описания перспектив генной терапии старения. Если быть быть более точными, для создание и реализации плана по радикальному продлению жизни человека.
Все подходы к генной терапии старения делятся на те, где в организм доставляется ген долголетия, и на те, где «выключается» ген или путь старения. В сравнении с другими подходами к продлению жизни генную терапию достаточно провести только один раз за всю жизнь.
Внедрение гена теломеразы (TERT), нарушение работы гена Agtr1a, нокаут GHRKO, нарушение в генах, кодирующих рецепторы к ИФР-1, сверх экспрессия FGF21, нокаут AC5, удаление RIP3, редактирование гена PCSK9, сверх экспрессия Klotho, нокаут RAGE, сверх экспрессия BubR1, сверх экспрессия MTH1 — всё это примеры самых эффективных способов генной инженерии, позволяющих продлевать жизнь животным до 30%.
Чтобы добиться более существенных результатов в генной терапии старения, необходимо комбинировать разные подходы. Частично повторить эффекты генотерапии можно с помощью фарм препаратов.
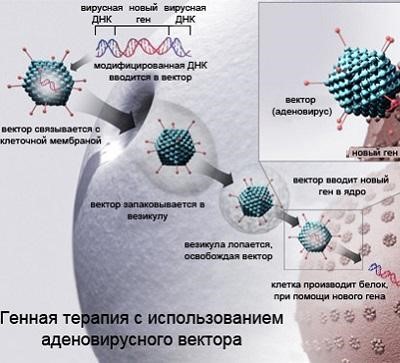
Концепция генной терапии существует на протяжении последних двадцати-тридцати лет. Она заключается в том, что наиболее радикальный способ борьбы с заболеваниями — это уничтожение самой генетической причины болезни, а не его следствий. Генная терапия — это вмешательство в работу клеточного «завода» по производству белков. Она позволяет, как активировать работу нужных генов, так и «выключать» вредные. В первом случае в клетку доставляют ген, с которого начинает считываться белок, необходимый для терапии заболевания. Во втором — в клетку вводятся регуляторные РНК, которые блокируют экспрессию «вредного» гена. По данным журнала Gene Medicine, в 2016 году было проведено 2300 клинических испытаний по генной терапии различных болезней. Это, преимущественно рак (64%), моногенные заболевания, вызванные мутацией в одном гене (9,5%), сердечно-сосудистые (7,9%) и инфекционные (7,9%). Для ряда заболеваний генная терапия оказалась вполне успешной.
К настоящему времени уже 3 генотерапевтических лекарства допущены к продаже. В Китае в 2003 году выпущен «Гендицин» (Gendicine) — препарат для лечения плоскоклеточного рака головы и шеи на основе гена p53, а в 2006 — «Онкорин» (Oncorine) — онколитический вирус для лечения назофарингеальной карциномы. В Европе в 2012 году запущено производство препарата «Глибера» (Glybera), предназначенного для терапии наследственного дефицита липопротеинлипазы (ЛПЛ) путем доставки одноименного гена.
Тяжелые комбинированный иммунодефицитный синдром (SCID) — это наследственное нарушение у детей, характеризующееся глубоко дефективной или отсутствием Т клеточной и В клеточной функций. SCID часто оказывается фатальным в течение первого года жизни, несмотря на проведение терапевтической трансплантации стволовых клеток или в случае дефицита аденозин деаминазы (ADA) проведенного замещения фермента. В апреле 2016 года Европейское агентство по безопасности продуктов питания и Европейское агентство лекарственных средств одобрили генную терапию этого заболевания препаратом Strimvelis.
30 августа 2017 года Управление по контролю за пищевыми продуктами и лекарственными средствами США (FDA) одобрена первая в мире генная терапия рака крови. Речь идет о Kymriah (tisagenlecleucel) компании Novartis Pharmaceuticals, который создан на основе технологии CAR-T и предназначен для лечения В-клеточного острого лимфобластного лейкоза у детей и молодых взрослых пациентов до 25 лет, рефрактерным к другим методам лечения или имеющим рецидив заболевания.
Использование технологии редактирования генома CRISPR/Cas9 открывает новые возможности в генной терапии. CRISPR/Cas9 позволяет очень точно и безопасно изменять ДНК клеток. И если совместить технологию CRISPR/Cas9 с доставкой при помощи аденоассоциированных вирусов, то это, по-видимому, позволит системно воздействовать на организм и совершенно безопасно изменять геном очень большого числа клеток.
И вот в 2016 году генетики из университета Дьюка (США) объявили, что им впервые в истории удалось успешно провести генную терапию взрослого млекопитающего (мыши) и вылечить его от генетического заболевания, связанного с дистрофией мышц. Для этого была использована модифицированная версия сравнительно новой технологии редактирования генов CRISPR/Cas9. Технология редактирования генов CRISPR/Cas9 связана с использованием аденоассоциированного вируса, помогающего доставлять генетический материал до места назначения. При помощи этой технологии были проведены успешные опыты по редактированию генов отдельных клеток в пробирках и одноклеточных эмбрионов. К сожалению, пока что возможность генетических манипуляций на эмбрионах человека вызывает ожесточённые споры.
CRISPR/Cas превзошел все ожидания. Он позволила с минимальным числом ошибок как «выключать» нужные гены, так и встраивать новые гены в строго определенные участки генома.
В декабре 2015 года научная группа Фенга Джанга видоизменила данную систему так, что она стала и вовсе безошибочной, что было опубликовано в ведущем научном журнале Science. Ученые заменили 3 аминокислоты «кирпичики», из которых состоит белок) в эндонуклеазе Cas9, после чего число ошибок такой системы свелось практически к нулю.
Использование CRISP/Cas9 особенно актуально для генной терапии старения, где требуется воздействовать на пути долголетия, общие для большинства клеток организма. По генной терапии старения до 2015 года не проведено ни одного клинического испытания на людях, что неудивительно, поскольку старение до сих пор не признано болезнью.
Кроме того, генная терапия старения пока еще очень молодая и развивающаяся область. Сейчас все исследования по генной терапии старения проводятся на модельных мышах, крысах, обезьянах и клеточных культурах человека — клетках в пробирке.
Все подходы к генной терапии старения делятся на те, где в организм доставляется ген долголетия, и на те, где вводятся малые РНК, «выключающие» ген или путь старения. То есть в первом случае вводится нечто полезное для долголетия, а во втором — отключается вредное. В строгом смысле исследований по генной терапии старения на млекопитающих до 2015 года было проведено только два.
Гораздо больше работ моделируют генную терапию на трансгенных мышах. В таких исследованиях терапевтический ген не доставляют в организм взрослой мыши, а при помощи генной инженерии создают мышей, геном которых изменен с рождения. Как и генная терапия, это позволяет исследовать, как увеличение или снижение активности разных генов влияет на продолжительность жизни и старение организма.
Давайте рассмотрим, что можно теоретически сделать с помощью генной терапии и генной инженерии для борьбы со старением.
Преимущество генной терапии перед другими способами продления жизни
Зачем нам генная терапия, если можно использовать препараты от старения (геропротекторы)? В сравнении с другими подходами к продлению жизни (например, геропротекторами или ограничением питания, продлевающими жизнь до 30–50%) генную терапию достаточно провести только один раз за всю жизнь, а таблетки нужно пить всё время и не забывать — иначе и результат будет не полным. Например, в работе Андржея Бартке 2001 года ограничение питания продлило жизнь мышам на 30%. Однако мыши употребляли низкокалорийную диету до 670 дней подряд — то есть каждый день, в течение половины своей жизни! Для большинства людей — это мало реально. А в эксперименте по генной терапии Марии Бласко (будет рассмотрено дальше в этой статье) 2012 года генная терапия теломеразой привела к немного меньшему эффекту — мыши стали жить дольше на 20%. Однако в этой работе мыши получили только 1 инъекцию лекарства в кровь за всю жизнь в довольно преклонном возрасте!
Поэтому, если мы говорим о трансляции исследований по продлению жизни на человека, то генная терапия имеет абсолютное преимущество, поскольку не снижает качество жизни из-за необходимости постоянного лечения — соблюдать ежедневно определенную диету или же постоянно употреблять геропротекторы или другие лекарства. Также генная терапия высокотаргетна и поэтому имеет потенциал к меньшему числу побочных эффектов.
Кроме того, лекарственные средства имеют ограничения по биодоступности в различные ткани и органы.
Внедрение гена теломеразы (TERT) у двухлетних мышей дикого типа (40–50 лет по человеческим меркам) с помощью одной инъекции увеличивает длину теломеров и продлевает им жизнь на 20%.

История исследований теломеразы уходит корнями еще в 1961 год. Американский исследователь Леонард Хейфлик культивировал фибробласты эмбриона человека в пробирке и заметил, что они способны поделиться не более 50 раз, после чего стареют. А если брать клетки более старых доноров, то делятся они и того меньше.
Ученый предположил, что в клетках существует некий счетчик делений, ограничивающий их общее число. Спустя 10 лет российским ученым Алексеем Оловниковых был предложен гипотетический механизм работы этого счетчика.
Оловников предположил, что при делении клеток концы хромосом, называемые теломерами, немного сокращаются. А когда теломеры достигают критической длины, клетка перестает делиться и стареет. В дальнейшем Элизабет Элен Блэкбёрн — американский учёный-цитогенетик, стала лауреатом Нобелевской премии по физиологии или медицине за 2009 год совместно с Кэрол Грейдер и Джеком Шостаком с формулировкой «за открытие механизмов защиты хромосом теломерами и фермента теломеразы» по теории, в 1971 году предложенной Алексеем Оловниковым.
В нестареющих клетках (например, половых и эмбриональных стволовых), напротив, должен существовать фермент, который удлиняет теломеры, позволяя клеткам делиться практически до бесконечности. Кроме того, было показано, что повреждение гена теломеразы сильно сокращает жизнь модельных животных и приводит к возникновению синдрома преждевременного старения — прогерии.
После открытия теломеразы десятки ученых загорелись тем, чтобы сделать на ее основе лекарство от старости. Казалось бы, «включение» теломеразы во всех клетках может сделать организм бессмертным. Однако вскоре возникли опасения в связи с тем, что активный синтез теломеразы наблюдается и в 90% раковых опухолей. Встал вопрос: не приведет ли активация теломеразы к риску злокачественной трансформации?
Кроме того, оказалось, что старение клеток далеко не всегда сопровождается сокращением теломер. Например, в случае эпителиальных клеток слизистой полости рта или роговицы глаза человека. Это говорило о том, что одной активации теломеразы может быть недостаточно для омоложения всего организма. Перед тем как перейти к генной терапии, эффекты теломеразы исследовались на трансгенных мышах. Оказалось, что если «включить» ген TERT во всех клетках мыши, то продолжительность жизни увеличивается на 40%! Однако постоянная активность теломеразы увеличивала и риск рака. Поэтому стал вопрос о том, как активировать работу теломеразы на более короткий срок.
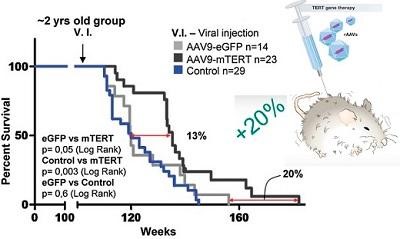
Именно это было сделано в работе Марии Бласко 2012 года (см. график). Ген теломеразы доставлялся в организм мыши при помощи аденоассоциированного вируса (AAV9), способного обеспечивать системную доставку. Аденоассоциированные вирусы характеризуются высокой безопасностью: они не встраивают доставляемый ген в геном хозяина, и поэтому не приводят к мутагенезу (нет риска рака). Кроме того, они почти не вызывают иммунный ответ. При этом, терапия геном TERT оказалась совершенно безопасной: риск рака у мышей не увеличивался. Двухлетним мышам делалась одна инъекция, с аденовирусом, к которому вставлен ген теломеразы. Это продлевало жизнь мышам на 20% (как показано на графике выше). А это теоретически может позволить сделать людям в возрасте 40–50 лет одну инъекцию такого лекарства и продлить жизнь ещё на 8–12 лет.
Сегодня простимулировать теломеразу можно и лекарствами. Интересное исследование в этой области провели ученые из Университета Любляны (Словения) в 2016 году после ряда успешных клинических испытаний по омоложению сосудов низкими дозами валсартана и флувастатина. На этот раз они измерили активность теломеразы после омоложения сосудов в образцах крови 130 пациентов пациентов.
Так одномесячный курс валсартана 20 мг + флувастатина 10–20 мг существенно повышает активность теломеразы в 3.28 раза, которая достоверно коррелирует с улучшением эндотелиальной функции (омоложением сосудов) и снижением воспаления в кровеносных сосудах. И этот повышенный уровень теломеразы сохраняется, постепенно снижаясь, ещё полгода. Но насколько эффективно такое повышение теломеразы влияет на теломеры ещё предстоит определить.
 Важно знать, что теломеры не обязательно могут продлить нам жизнь, если подобную терапию делать не в нужный момент и слишком долго.
Важно знать, что теломеры не обязательно могут продлить нам жизнь, если подобную терапию делать не в нужный момент и слишком долго.
К тому же одна лишь стимуляция теломеразы может не удлинить теломеры. Активность теломеразы с возрастом почти не меняется — вот посмотрите график слева. А теломеры всё равно сокращаются.
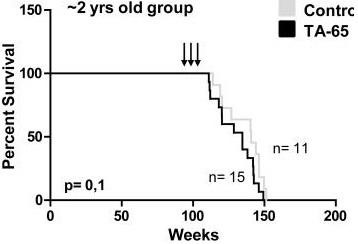 Также сегодня есть на рынке препарат, который повышает активность теломеразы — ТА-65. Он очень дорогой, а жизнь мышей никак не продлевал в исследованиях. Вот смотрите график слева. В исследовании 2011 года ученые из Испанского Национального Онкологического Центра начали давать долгоживущим двух летним мышам ТА-65 для повышения теломеразы, как и в предыдущем исследовании. Только в предыдущем исследовании мышам делали инъекцию для генной терапии. Но препарат ТА-65 никак не продлил жизнь мышам в отличие от генной терапии (см. график слева) и оказался абсолютно бесполезным для продления жизни и замедления старения.
Также сегодня есть на рынке препарат, который повышает активность теломеразы — ТА-65. Он очень дорогой, а жизнь мышей никак не продлевал в исследованиях. Вот смотрите график слева. В исследовании 2011 года ученые из Испанского Национального Онкологического Центра начали давать долгоживущим двух летним мышам ТА-65 для повышения теломеразы, как и в предыдущем исследовании. Только в предыдущем исследовании мышам делали инъекцию для генной терапии. Но препарат ТА-65 никак не продлил жизнь мышам в отличие от генной терапии (см. график слева) и оказался абсолютно бесполезным для продления жизни и замедления старения.
В 2011 году ученые из Техасского Университета исследовали теломеры и теломеразу в культурах клеток более 60 видов млекопитающих. Роль теломер в долголетии оказалось не так очевидна… Исследования показывают (при сравнении около 60 видов млекопитающих), чем длиннее теломеры у вида, тем быстрее накапливаются у него мутации ДНК, больше раковых опухолей и короче продолжительность жизни. Длина теломер обратно коррелирует с продолжительностью жизни. Это даёт основания предполагать, что результат по продлению жизни теломеразой, который был получен на мышах с помощью одной инъекции, может не продлить жизнь людям. Вопрос по теломерам для людей остаётся открытым.
Вывод: В будущем теоретически мы сможем с помощью внедрения гена теломеразы (TERT) в возрасте 40–50 лет с помощью одной инъекции увеличивать длину теломеров, но одной такой терапии явно недостаточно. Быстрее всего, мы должны найти сочетание генотерапевтических воздействий, чтобы существенно продлить жизнь человека. Сегодня мы можем имитировать эффект с помощью одномесячной терапии 1 раз в полгода комбинацией препаратов валсартана 20 мг + флувастатина 10–20 мг, либо телмисартан + аторвастатин 10 мг. По крайне мере эти препараты в комбинации способны стимулировать саму теломеразу.
Нарушение работы гена Agtr1a, кодирующего рецепторы ангиотензина AT1a продлевает жизнь трансгенным мышам на 26% в сравнении с мышами дикого типа.
Антагонисты рецепторов ангиотензина II, или блокаторы АТ1-рецепторов — одна из новых групп антигипертензивных средств (лекарства для лечения артериального давления). К таким лекарствам можно отнести все лекарства группы сартанов (например, телмисартан).
Как было показано в исследованиях, эти лекарства сильно продлевают жизнь животным и даже людям. Например, по данным исследования 2007 года, проведенного учеными из Университета Буэнос-Айрес (Аргентина) один из сартанов лозартан, когда его давали 40 крысам линии Вистар, то он продлевал их максимальную продолжительность жизни на 18% в сравнении с другими 40 крысами в контрольной группе.
 Можно повлиять на АТ1-рецепторы и генетически, воздействуя на ген Agtr1a. Таким образом решается проблема доставки лекарства во все ткани и органы. Уникальное исследование провели исследователи из Института Фармакологических Исследований (Италия) и Университета Дьюка (США) в 2009 году. Как мы можем видеть на графике, нарушение работы гена Agtr1a, кодирующего рецепторы ангиотензина AT1a продлевает жизнь 20 трансгенным мышам по сравнению с 10-ю мышами дикого типа на 26%. Судя по исследованиям замедлилось функциональное старение органов и тканей.
Можно повлиять на АТ1-рецепторы и генетически, воздействуя на ген Agtr1a. Таким образом решается проблема доставки лекарства во все ткани и органы. Уникальное исследование провели исследователи из Института Фармакологических Исследований (Италия) и Университета Дьюка (США) в 2009 году. Как мы можем видеть на графике, нарушение работы гена Agtr1a, кодирующего рецепторы ангиотензина AT1a продлевает жизнь 20 трансгенным мышам по сравнению с 10-ю мышами дикого типа на 26%. Судя по исследованиям замедлилось функциональное старение органов и тканей.
Такая генотерапия может быть использована и у пожилых для продления жизни. Особенно актуалено воздействие на АТ1-рецепторы для людей с повышенным артериальным давлением.
Вывод: В будущем с помощью генотерапии мы можем нарушать работу гена, кодирующего рецепторы ангиотензина AT1 и продлевать жизнь человека на 5–15 лет (такие сроки взяты путем экстраполяции результатов полученных на животных) в зависимости от состояния пациента. Сегодня частичного эффекта (ввиду не полной биодоступности во все ткани организма) можно добиваться терапией курсовых приёмов в малых дозах лекарства телмисартан в дозе 10 мг в сутки, если нет высокого артериального давление — иначе дозы выше.
Нокаут гена, кодирующего рецепторы гормона роста GHRKO (выборочное удаление рецепторов гормона роста) продлевает жизнь трансгенным мышам примерно на 30% в сравнении с мышами дикого типа.
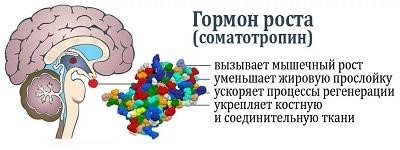 В организме человека гормон роста регулирует уровень ИФР-1 (инсулиноподобный фактор роста 1 типа). Это происходит так. Гормон роста секретируется в передней доли гипофиза. Затем гормон роста связывается с рецепторами в печени. Благодаря связыванию с рецепторами гормона роста, в печени начинает секретироваться инсулиноподобный фактор роста 1 типа (ИФР-1).
В организме человека гормон роста регулирует уровень ИФР-1 (инсулиноподобный фактор роста 1 типа). Это происходит так. Гормон роста секретируется в передней доли гипофиза. Затем гормон роста связывается с рецепторами в печени. Благодаря связыванию с рецепторами гормона роста, в печени начинает секретироваться инсулиноподобный фактор роста 1 типа (ИФР-1).
Если рецепторы гормона роста не заблокированы или не «поломаны», то чем выше гормон роста, тем выше и ИФР-1. Сегодня один из самых доказанных почти на всех видах животных (www.karger.com/Article/Abstract/212538; www.ncbi.nlm.nih.gov/pubmed/19590001) метод продления жизни — это снижение ИФР-1 (инсулин подобный фактор роста 1 типа) с помощью голоданий, либо с помощью диеты FMD, разработанной ученым Вальтером Лонго из Университета Южной Калифорнии (США) в 2015 году.
Но для этого нужно всю жизнь соблюдать диету, что по силам далеко не каждому.
ИФР-1 — гормон, который связывается с рецепторами ИФР-1. И вот, если генетически нарушить работу рецепторов ИФР-1, то можно частично имитировать недостаток ИФР-1.
По данным исследования 2008 года, сделанного учеными из Института Альберта Эйнштейна (США), нарушение в генах, кодирующих рецепторы к ИФР-1 у 197 евреев потомков долгожителей Ашкеназии (105 женщин и 92 мужчин) возможно объясняет их феномен долгожительства. Похоже, что у супердолгожителей, которые живут более 100 лет, в детстве и во взрослом возрасте был оптимальный (не такой высокий, как у остальных людей) уровень ИФР-1, либо был высокий ИФР-1, но при этом генетически обусловленный дефект рецепторов к ИФР-1.
А вдруг оптимизация ИФР-1 и снижение смертности — просто совпадение. Ведь долгожителей не так много. О такой взаимосвязи нам бы сказали исследования на больших группах людей. Такие исследования есть.
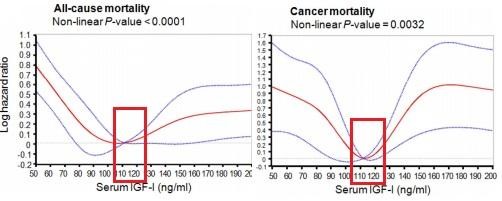
Данные исследований предлагают, что есть уровень ИФР-1, выше и ниже которого риск смерти от рака и от других причин у людей повышается.
Этот диапазон примерно от 105 нг/мл до 120 нг/мл. (см. график слева). Данный факт показали в своих исследованиях шведские ученые из Университета Гетеборга в 2012 году в результате изучения 2901 пациента, а также американские ученые из Школы Геронтологии Дэвиса при Университете Южной Калифорнии в 2014 году. У людей в возрасте от 50 до 65 лет ИФР-1 на уровне от 105 до 120 нг/мл был связан с наименьшей общей смертностью в следующие 18 лет.
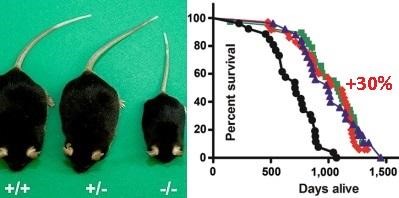 Нокаут у мышей гена, кодирующего рецепторы гормона роста GHRKO (выборочное удаление рецепторов гормона роста) продлевает жизнь трансгенным мышам примерно на 30% в сравнении с мышами дикого типа.
Нокаут у мышей гена, кодирующего рецепторы гормона роста GHRKO (выборочное удаление рецепторов гормона роста) продлевает жизнь трансгенным мышам примерно на 30% в сравнении с мышами дикого типа.
На графике: чёрный цвет линии — это мыши дикого типа. График синего цвета — это мыши дикого типа, которых недокармливали, чтобы снижать у них ИФР-1 (они прожили на 30% дольше мышей дикого типа).
Красная линия — это мыши у которых генетически низкий ИФР-1, так как у них нокаутировали ген, кодирующий рецепторы гормона роста GHRKO. Они прожили на 30% дольше мышей дикого тип).
Зелёная линия — это те же мышки с нокаутом гена, кодирующего рецепторы гормона роста GHRKO, но которых также недокармливали — их недокармливание уже не давало преимуществ, так как ИФР-1 у них был и так уже снижен генетически. Что это нам даёт? То, что если людям генетически снизить ИФР-1 до оптимального, то им не нужно голодать периодически, чтобы продлить сильно жизнь.
 Интересно, что именно с подобной генной инженерией была создана мышь, которая установила рекорд по продолжительности жизни.
Интересно, что именно с подобной генной инженерией была создана мышь, которая установила рекорд по продолжительности жизни.
Эта мышь с необычным именем GHR-KO 11C, созданная Анджеем Бартке (Andrzej Bartke) — эндокринологом из Медицинской Школы Университета Южного Иллинойса, расположенной в Спрингфилде (США).
Его мышь не дожила всего 6 дней до своего пятилетия, прожив 1819 дней. Поставить рекорд удалось благодаря отключению у грызуна ген-рецептор гормона роста, что позволило у неё сильно снизить ИФР-1.
25 сентября 2003 года Анджей Бартке получил Longevity Prize — приз за долголетие созданной им мыши. Полезно знать, что немного имитировать эффект снижения ИФР-1 может лекарство от сахарного диабета метформин в дозировке 500 мг в сутки.
Так в исследовании китайских ученых из Сианьского Транспортного Университета на 60 женщинах с диагнозом рак эндометрия было показано, что высокая концентрация ИФР-1 в плазме у 30 женщин с раком эндометрия снижалась в два раза через 3–4 недели лечения с помощью обычных доз метформина (500 мг 3 раза в сутки).
Вывод: В будущем нокаут гена, кодирующего рецепторы гормона роста GHRKO (выборочное удаление рецепторов гормона роста), либо нарушение в работе генах, кодирующих рецепторы ИФР-1 с помощью генной терапии возможно продлит нашу жизнь лет на 5–17. Сегодня мы можем получить подобный эффект с помощью голоданий, либо с помощью низкокалорийной диеты с низким содержание белка. Кроме того, немного имитировать данный эффект снижения ИФР-1 может препарат для лечения сахарного диабета 2-го типа метформин в дозировке 500 мг в сутки.
Генетическая сверх экспрессия FGF21 (фактора роста фибробластов 21) заметно увеличивает продолжительность жизни у трансгенных мышей в сравнении с мышами дикого типа.
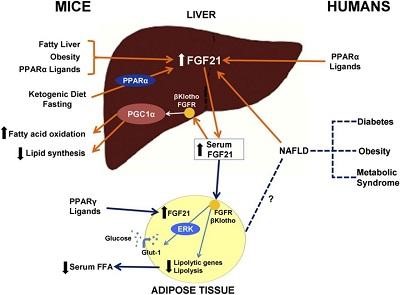 Фактор роста фибробластов-21 (FGF21) — это гормон, секретируемый печенью в периоды голодания для того, чтобы помочь организму адаптироваться к недостатку питательных веществ.
Фактор роста фибробластов-21 (FGF21) — это гормон, секретируемый печенью в периоды голодания для того, чтобы помочь организму адаптироваться к недостатку питательных веществ.
FGF21 также синтезируется печенью в ответ на сахарный диабет и многие другие проблемы со здоровьем и даже при употреблении алкоголя. FGF21 блокирует рецепторы гормона роста из-за чего снижается синтез ИФР-1 печенью.
Более низкий, чем обычно ИФР-1 во многих исследованиях сильно продлевал жизнь животным и снижал смертность у людей. Было бы интересно проверить, можно ли просто генетически заставить организм секретировать больше FGF21. Продлит ли это значительно жизнь? Как оказалось — можно.
Кстати, имитировать эффект повышения FGF21 способен метформин в дозировке 500 мг в сутки.
Так в 2013 году учеными из Университета Сонгюнгван (Корея) было показано, что уровень FGF21 в сыворотке крови у людей с сахарным диабетом был повышен через полгода лечения метформином.
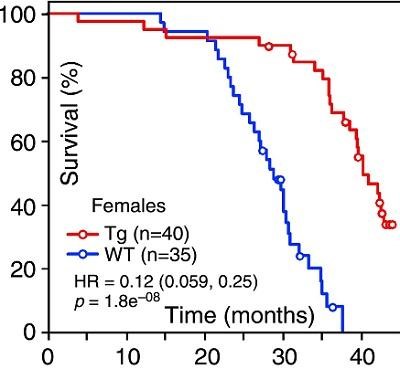 Ученые из Университета Техаса (США) в исследовании 2012 года показали, что генетическая сверхэкспрессия FGF21 (фактора роста фибробластов 21) заметно увеличивает продолжительность жизни трансгенных мышей (на графике красная линия) в сравнении с мышами дикого типа (на графике синяя линия), не снижая потребление пищи.
Ученые из Университета Техаса (США) в исследовании 2012 года показали, что генетическая сверхэкспрессия FGF21 (фактора роста фибробластов 21) заметно увеличивает продолжительность жизни трансгенных мышей (на графике красная линия) в сравнении с мышами дикого типа (на графике синяя линия), не снижая потребление пищи.
Вывод: В будущем генетическая сверх экспрессия FGF21 (фактора роста фибробластов 21) может заметно увеличить нашу продолжительность жизни без снижения потребления пищи. Частично имитировать эффект повышения FGF21 может лекарство от сахарного диабета метформин в дозировке 500 мг в сутки. Но метформин смертельно опасно употреблять людям с повышенном выше нормы креатинином в анализах крови. Поэтому перед употреблением врач обязан назначить анализ крови на креатинин. В остальном метформин считается лекарством с высоким профилем безопасности.
Генетический нокаут Аденилат циклазы 5-го типа продлевает жизнь трансгенным мышам на 30% в сравнении с мышами дикого типа.
Мы рассмотрели, как можно с помощью генетической терапии имитировать эпизодические голодания и сильно продлевать жизнь. Оказывается, есть и другой способ добиться тех же эффектов, но уже не имитируя голодания, а снижая воздействие гормонов стресса на наш организм.
Хороший способ повысить стрессоустойчивость организма — это блокировать передачу сигнала от гормона стресса — адреналина в клетку. Таким качеством обладает препарат пропранолол. Также ингибирует адренолиновый сигнал AC5 литий (www.ncbi.nlm.nih.gov/pubmed/18205980; www.ncbi.nlm.nih.gov/pubmed/19922557). Оба этих лекарства являются потенциальными геропротекторами (веществами, продлевающими жизнь).
Надо отметить, что совмещать генетическую блокаду рецепторов гормона роста и Аденилатциклазы 5-го типа (АС5) нельзя. Как показано в исследовании 2013 года (Университет Медицины и Стоматологии Нью-Джерси — США), мыши в таком эксперименте умерли уже через месяц, будто бы голодали. Этим мышам заблокировали АС5 и сократили рацион питания по калорийности. Поэтому либо голодать, либо полностью заблокировать АС5. Либо голодать и снизить излишнюю активность АС5, но не блокировать её полностью.
Адреналин — гормон, который вызывает реакцию бей-беги («flight or fight»); он начинает активно выделяться при ощущении опасности, страхе, травмах, ожогах, шоке и в пограничных ситуациях, мобилизуя организм для устранения угрозы. При этом адреналин сильный стресс гормон, при длительном воздействии он повреждает клетки и целые ткани, приводя к истощению организма, разрушает сердце.
Американский исследователь Stephen F. Vatner с коллегами создал трансгенных мышей с «выключенным» геном аденилатциклазы 5 типа (AC5) — молекулы, необходимой для передачи адреналинового сигнала в клетки через один из типов его рецепторов — β-адренорецепторы.
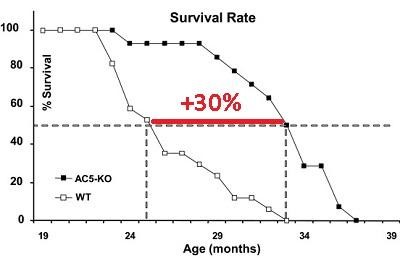 Такие рецепторы присутствуют почти на всех клетках организма. Посмотрите на графике. Нокаут АС5 сильно продлевал медианную продолжительность жизни трансгенным мышам — на 30% по сравнению с мышами дикого типа, защищал сердце от старения, защищал от диабета 2-го типа и ожирения.
Такие рецепторы присутствуют почти на всех клетках организма. Посмотрите на графике. Нокаут АС5 сильно продлевал медианную продолжительность жизни трансгенным мышам — на 30% по сравнению с мышами дикого типа, защищал сердце от старения, защищал от диабета 2-го типа и ожирения.
На молекулярном уровне эти эффекты были связаны с тем, что инактивация AC5 запускала путь стрессоустойчивости — Raf/MEK/ERK.
В результате клетка вырабатывала целый набор защитных молекул, запускала механизмы выживания клеток. Кроме того, из более ранних работ известно, что действие адреналина на клетку через β2 -адренорецепторы непосредственно вызывает повреждения ДНК.
Таким образом, можно предположить, что «выключение» гена AC5 мышей способствовала еще и повышенной стабильности генома.
Интересно, что подавление или блокада AC5 у мышей защищает от многих видов рака, в том числе от меланомы. Сегодня FDA в США одобрила противовирусный препарат аденин-9-β-д-арабинофуранозид (Vidarabine или AraAde), который специфически блокирует АС5 и может быть полезным для лечения меланомы и рака лёгких.
Таким образом, ингибирование АС5 — это новый механизм для профилактики раковых заболеваний, связанных со старением.
Есть также свидетельства, которые показывают, что подавление АС5 лекарством пропранолол заблокировало развитие атеросклероза у обезьян и продлевало жизнь людям.
То, что эмоциональный стресс повышает давление и вызывает болезни сердца — наглядно показано в работе американского ученого Дж. Каплана в 1988 году.
Каплан на примере приматов показал, что если собрать группу самцов приматов, то в течение скольких-то дней у обезьян появится социальная иерархия. Самое худшее место в такой иерархии — это внизу. Самцы приматов, находящиеся в подчиненном положении, демонстрируют ряд показателей хронического стресса. Часто у них возникает атеросклероз. Когда учёные давали самцам приматов, находящимся внизу социальной иерархии (группа риска), бета-блокатор пропранолол, подавляющий активность симпатической нервной системы, то атеросклероз сосудов не развивался.
Оказалось, что симпатическая нервная система из-за стресса негативно влияет на развитие атеросклероза и участвует в проблемах с сердцем и сосудами. Эмоциональный стресс реализует себя через симпатическую (адренергическую) автономную нервную систему, которая связывает управляющие центры нашего мозга и внутренние органы. В том числе — с иммунными, костным мозгом и др. Атеросклероз — главный фактор, который приводит к наибольшему число смертей в развитых странах от инфаркта сердца и инсульта мозга.
Рандомизированное, двойное слепое, плацебо-контролируемое исследование 1983 года, организованное Goldstein S и коллегами, показало, что терапия пропранололом у 3837 пациентов с острым инфарктом миокарда снижает смертность от сердечно-сосудистых заболеваний (причина смертности №1 в мире).
Опубликованное в 1997 году трехлетнее наблюдение пациентов 60–69 лет из США, которые перенесли инфаркт миокарда, показало, что пропранолол снижал у таких пациентов общую смертность на 35–37%. Кроме того, пропранолол вызывал уменьшение признаков болезни и старения сердца (значительно большее увеличение фракции выброса левого желудочка и значительно большее снижение массы миокарда левого желудочка).
Вывод: В будущем мы можем делать генетический нокаут, либо снижение эффективности работы Аденилат циклазы 5-го типа с помощью генной терапии и сильно продлевать себе жизнь. Но и сегодня мы можем добиваться этого же эффекта медикаментозно, если действовать очень аккуратно под наблюдением врача с помощью лекарства пропранолол, который блокирует именно все бета адренергические рецепторы, а не некоторые, как это делают селективные бета-адреноблокаторы. Но нужно помнить, что нельзя заниматься самолечением, так как при правильном применении пропранолол способен значительно продлить жизнь. Но если пропранолол применять, не учитывая противопоказаний, которые может определить только опытный специалист, то пропранолол может привести к летальному исходу!!! Немного блокировать АС5 (до 50%) может и литий в минидозах — значительно более низких, чем высокие дозы, используемые в лечении когнитивных растройств.
Удаление RIP3 (рецептор взаимодействия серин/треонин-протеинкиназы 3) продлевает жизнь атеросклеротических мышей на 30% — до уровня здоровых мышей дикого типа.
Систематическое воспаление способствует развитию многих заболеваний, включая сердечно-сосудистые заболевания, которые являются ведущей причиной смертности во всем мире. Интересно, что если в сосудах подавить воспаление, то даже у мышей с высоким холестерином (с плохой генетикой в отношении атеросклероза) атеросклероз не развивается, и мыши живут также долго, как и мыши дикого типа.
Речь идёт о мышах с «Арое−/−» — экстремальной моделью атеросклероза. Арое — аполипопротеин Е. У таких мышей очень быстро повышается холестерин в крови (особенно ЛПНП) и развивается атеросклероз. Казалось бы, что если не снизить холестерин, то их не спасти. Но как оказалось, если подавить воспаление, то эти мыши могут не болеть атеросклерозом даже при высоком холестерине в крови
[www.ncbi.nlm.nih.gov/pmc/articles/PMC4066890].
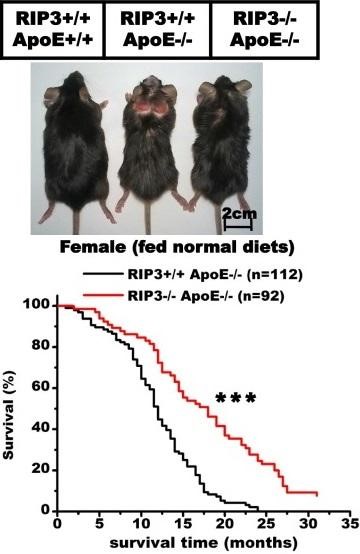 У людей также бывает плохая генетика по Apoe и высокий уровень холестерина. Исследование 2015 года китайских ученых из Национального Института Биологических Наук показывает, что можно отменить ускоренное старение при такой генетике, иметь здоровое сердца и сосуды. Видите, на картинке, когда у мышек ApoE +/+ — нет дефицита ApoE, то всё ок. Они выглядят здоровыми. Когда у мышек ApoE -/-, то они выглядят больными. Но когда при ApoE -/- генетически удалить RIP3 (RIP3-/-), то воспаление в сосудах снижается, и мышки опять выглядят здоровыми и живут также долго, как и мышки с ApoE +/+ даже с по прежнему высоким уровнем холестерина в крови.
У людей также бывает плохая генетика по Apoe и высокий уровень холестерина. Исследование 2015 года китайских ученых из Национального Института Биологических Наук показывает, что можно отменить ускоренное старение при такой генетике, иметь здоровое сердца и сосуды. Видите, на картинке, когда у мышек ApoE +/+ — нет дефицита ApoE, то всё ок. Они выглядят здоровыми. Когда у мышек ApoE -/-, то они выглядят больными. Но когда при ApoE -/- генетически удалить RIP3 (RIP3-/-), то воспаление в сосудах снижается, и мышки опять выглядят здоровыми и живут также долго, как и мышки с ApoE +/+ даже с по прежнему высоким уровнем холестерина в крови.
На графике также видно, что мышки с дефицитов ApoE -/- имели сильное воспаление в сосудах из-за RIP3 +/+ и жили не более 25 месяцев. Стоило удалить им RIP3 (RIP3 -/-), то такие мышки уже жили 32 месяца — до уровня продолжительности жизни мышей дикого типа.
RIP3 при высоком холестерине в крови стимулируют некроз в сосудах с выделением цитокинов, которые мобилизуют моноциты из костного мозга в участки поражения с последующим их превращением в макрофаги и т. д. — образуются холестериновые бляшки, а в анализах крови повышается фактор некроза опухоли ФНО.
Удаление RIP3 подавляет некроз и сним
