Экспансия фронта бактерий по арене с антибиотиками: зрелищный эксперимент Гарвардской медицинской школы
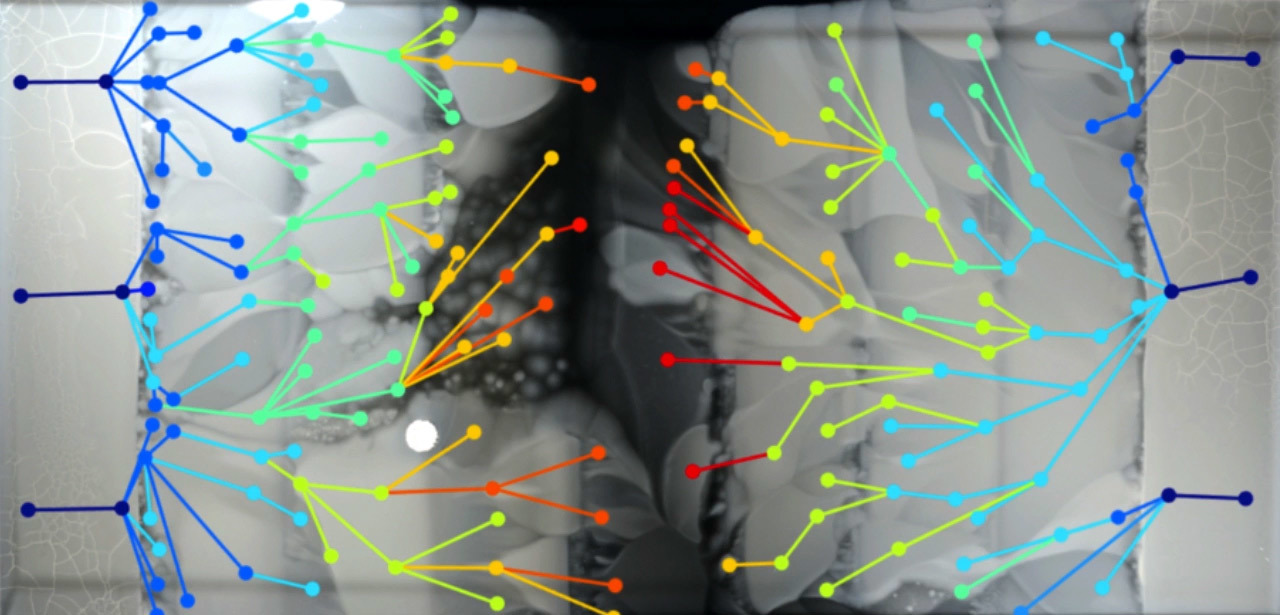
По мере увеличения сопротивления со стороны антибиотика в популяции бактерий возникают параллельные линии эволюции, которые различаются по фенотипу и генотипу. Кадр из демонстрационного видео Гарвардской медицинской школы
Обычно в лабораторных опытах бактерий разводят в однородной среде. Учёные из Гарвардской медицинской школы пошли дальше. Они организовали необычный эксперимент по эволюции бактерий в смешанной среде — на огромном «блюде» размером 120×60 см.
Пространство разделили на зоны с разной концентрацией антибиотика, так что в следующую зону проходят только поколения бактерий с подходящими мутациями. В результате, в финальный раунд по центру арены пробиваются «супермикробы», то есть максимально изменившие свой генотип и фенотип в результате эволюционного отбора (см. об изоляции приспособленцев в конце статьи).
Арена битвы микробов с антибиотиками называется MEGA (microbial evolution and growth arena). Такая среда специально создана, чтобы при экспоненциальном росте численности бактерий они не соревновались друг с другом за ограниченные ресурсы, как это принято в большинстве научных экспериментов. Здесь ресурсы практически не ограничены, а от бактерий требуется только захватывать новые территории и приспосабливаться к новым условиям жизни, умножая свою численность практически без ограничений. В этом смысле движение бактериального фронта напоминает экспансию человеческого вида на планете Земля в средние века с колонизацией новых территорий (предположительно, экспансивное развитие человеческой расы продолжится и за пределами родной планеты с колонизацией всех пригодных для жизни территорий в зоне досягаемости).

Арена MEGA. Кадр из демонстрационного видео Гарвардской медицинской школы
Эксперимент имеет не только научную, но и образовательную ценность. Большое пространство арены MEGA позволяет визуально наблюдать мутации и естественный отбор при распространении фронта бактериальной популяции. Впечатляющее зрелище.
Проведённые ранее исследования показали, что структурированные микросреды такого типа увеличивают скорость эволюции в маленьких популяциях бактерий с изменением генотипа (Q. Zhang et al., Science 333, 1764–1767 (2011)). Но до сих пор оставался неизученным вопрос, как именно это происходит в больших популяциях.
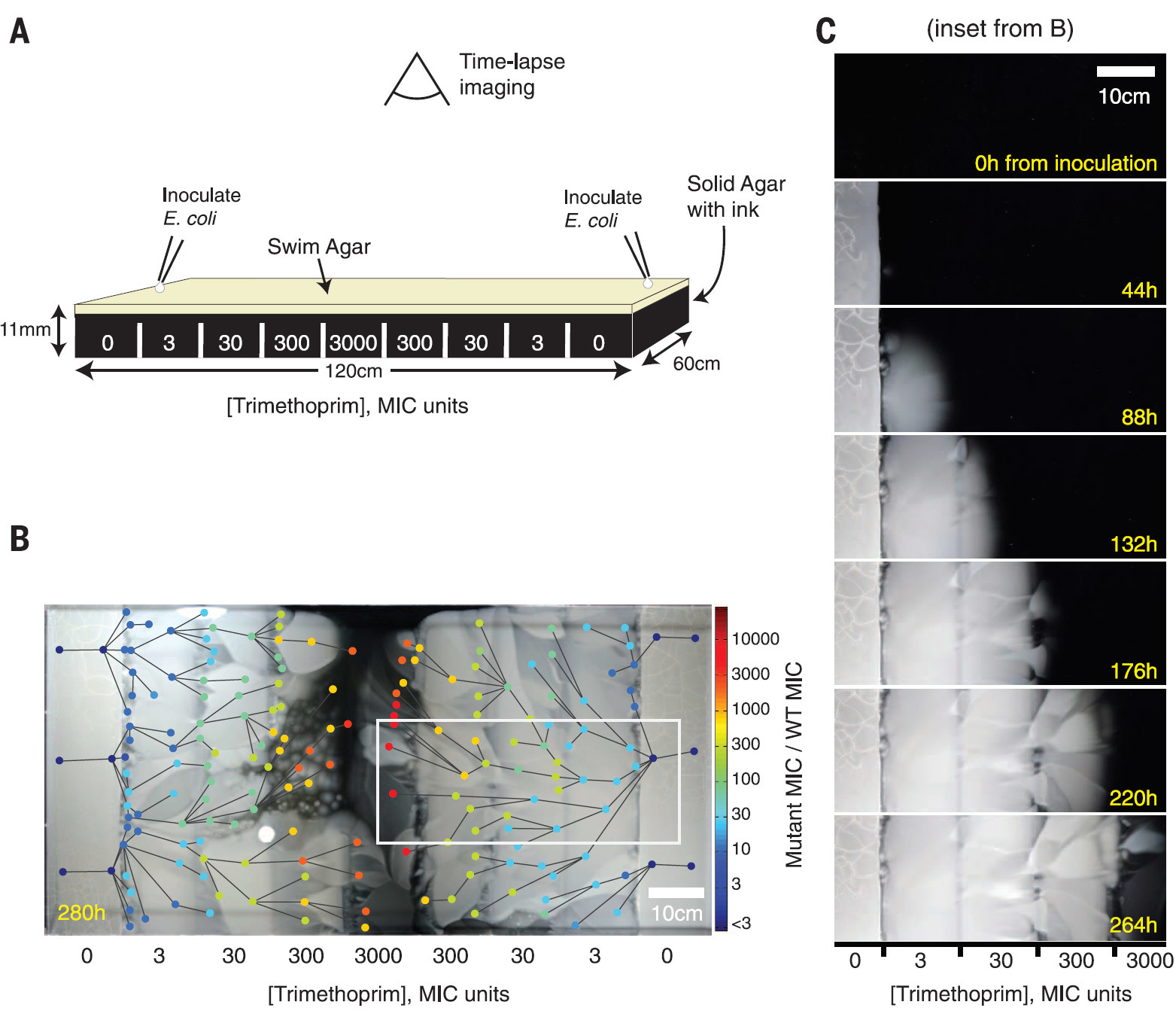
Для такого эксперимента была сконструирована прямоугольная чашка Петри размером 120×60 см, структурированная по зонам с экспоненциальным увеличением концентрации антибиотика триметоприм от периферии к центру, а также с питательными веществами для размножения бактерий. Большая площадь арены не позволяла бактериям E. coli смешиваться между собой, чтобы более наглядно наблюдать происходящие мутации.
Конструкция арены MEGA и результат распространения бактериального фронта в течение 12 суток показаны на иллюстрации B. Кругами разного цвета обозначены 182 вида мутировавших бактерий, цвет обозначает концентрацию бактерий. Линии между видами соответствуют направлению мутации, исходя из данных видеосъёмки.
По мере постоянного увеличения сопротивления со стороны антибиотика в популяции бактерий возникают многочисленные параллельные линии эволюции, которые различаются по фенотипу и генотипу.
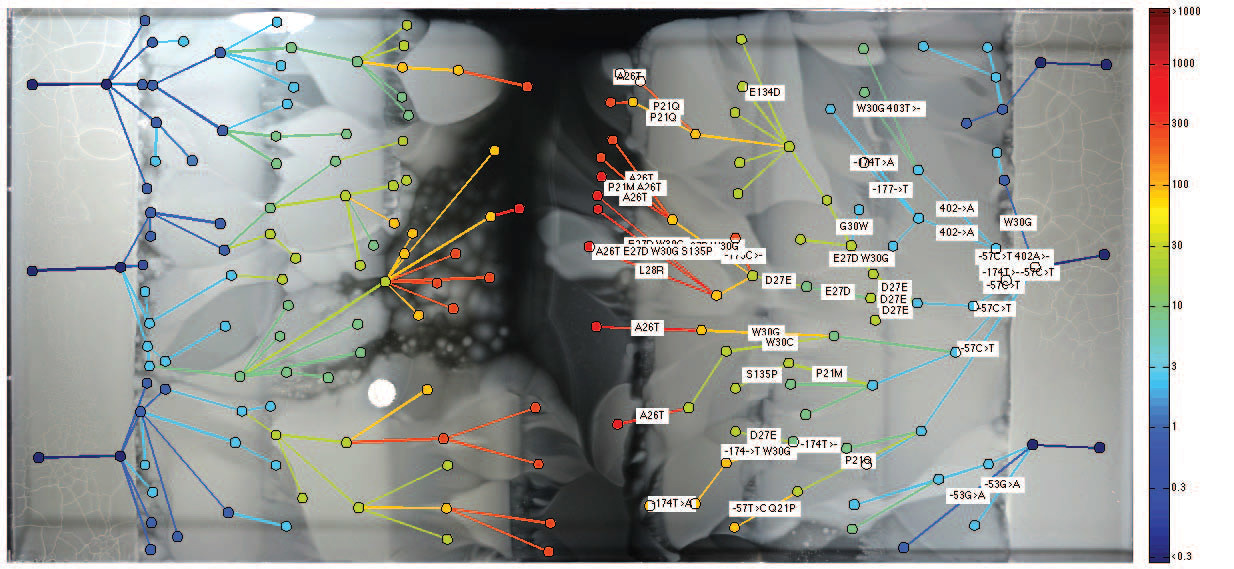
Изучив бактерий в авангарде и позади фронта бактериальной популяции, учёные выяснили несколько интересных вещей. Оказалось, что эволюцию не всегда движут вперёд бактерии, наиболее устойчивые к антибиоткам. Как ни странно, иногда самые устойчивые потомственные линии оказываются заперты позади более чувствительных бактерий. Судя по всему, это происходит из-за «преждевременных» мутаций, когда некоторые бактерии оказываются готовы выжить в более высокой концентрации антибиотика, которая появится в будущем, но ещё не появилась. В такой ситуации потенциально более приспособленные бактерии уступают место во фронте своим сородичам, которые приспособлены именно к актуальной концентрации, существующей в данный момент.
Для проверки этой теории учёные взяли образцы изолированных колоний бактерий с «преждевременными» мутациями и насильно поместили их впереди фронта. Как и предполагалось, они выжили в условиях, в которых основной бактериальный фронт выжить не может.

Пространственная ловушка компенсаторных мутаций — бактерии, которые настолько опередили своё время, что даже после наступления подходящих условий они уже заперты позади наступившего фронта. Иллюстрация: Гарвардская медицинская школа
Учёные тщательно изучили генотип наиболее мутировавших видов бактерий, которые сумели выжить в растворе с максимальной концентрацией триметоприма. Выяснилось, что у этих видов чаще всего мутации подвергался ген folA, который кодирует дигидрофолат-редуктазу (DHFR) и является мишенью триметоприма. Чем больше сопротивляемость бактрии к антибиотику — тем больше было мутаций в этом гене. Кроме того, обнаружены мутации в нескольких других генах, не имеющих отношения к действию конкретного антибиотика. Среди них были опероны mar и sox, которые отвечают за реакцию на стресс. Ранее было известно, что эти «стрессовые» гены играют важную роль для успешного сопротивления антибиотикам.
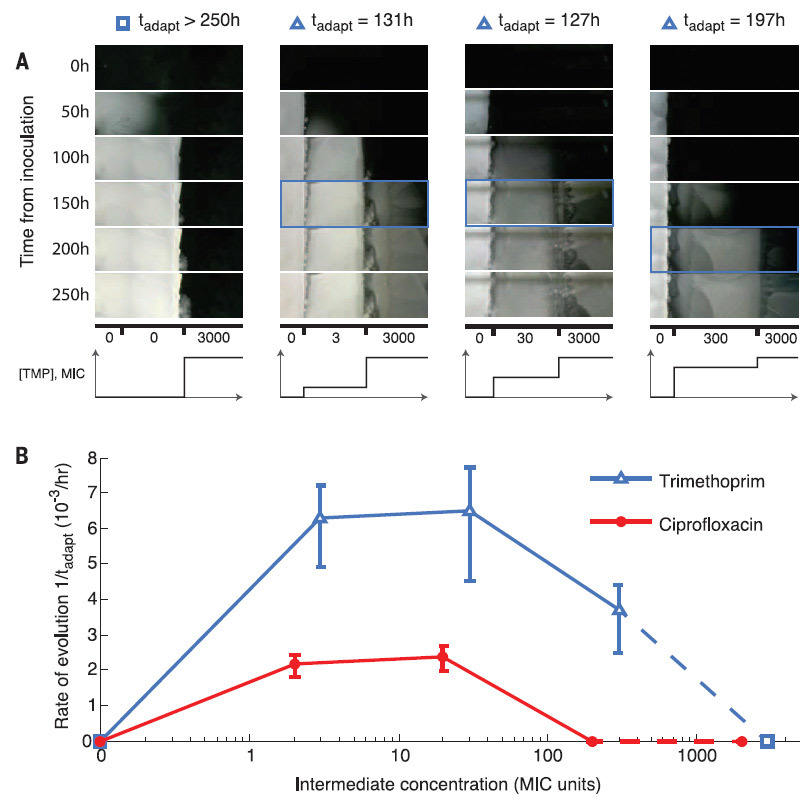
Учёные также выяснили, что лучшая адаптация к слабому воздействию антибиотика ускоряет впоследствии адаптацию к более высоким концентрациям (на иллюстрации внизу). Всё как у людей, которые способны лучше приспособиться к ухудшающимся условиям жизни, если изменения происходят постепенно и незаметно.
Эксперимент описан в научной статье, опубликованной 9 сентября 2016 года в журнале Science (doi:10.1126/science.aag0822).
