Новый алгоритм усиливает фокусировку самых мощных микроскопов
В криминальных сериалах и фильмах бывают моменты, когда детектив просматривает зернистые кадры с камер наблюдения с низким разрешением, замечает на пленке интересную деталь или человека и небрежно просит специалиста «увеличить это». Несколько щелчков по клавиатуре и вуаля — герои получают идеальное, четкое изображение лица подозреваемого. Такой технологии, конечно, еще нет в реальном мире.
Однако ученые недавно разработали настоящий «улучшающий» инструмент для увеличения разрешения и усиления точности мощных микроскопов, которые используются в биологии и медицине.
Команда исследователей продемонстрировала, как новый компьютерный алгоритм улучшает качество трехмерных схем молекулярной структуры, создаваемых с помощью криоэлектронной микроскопии (крио-ЭМ).
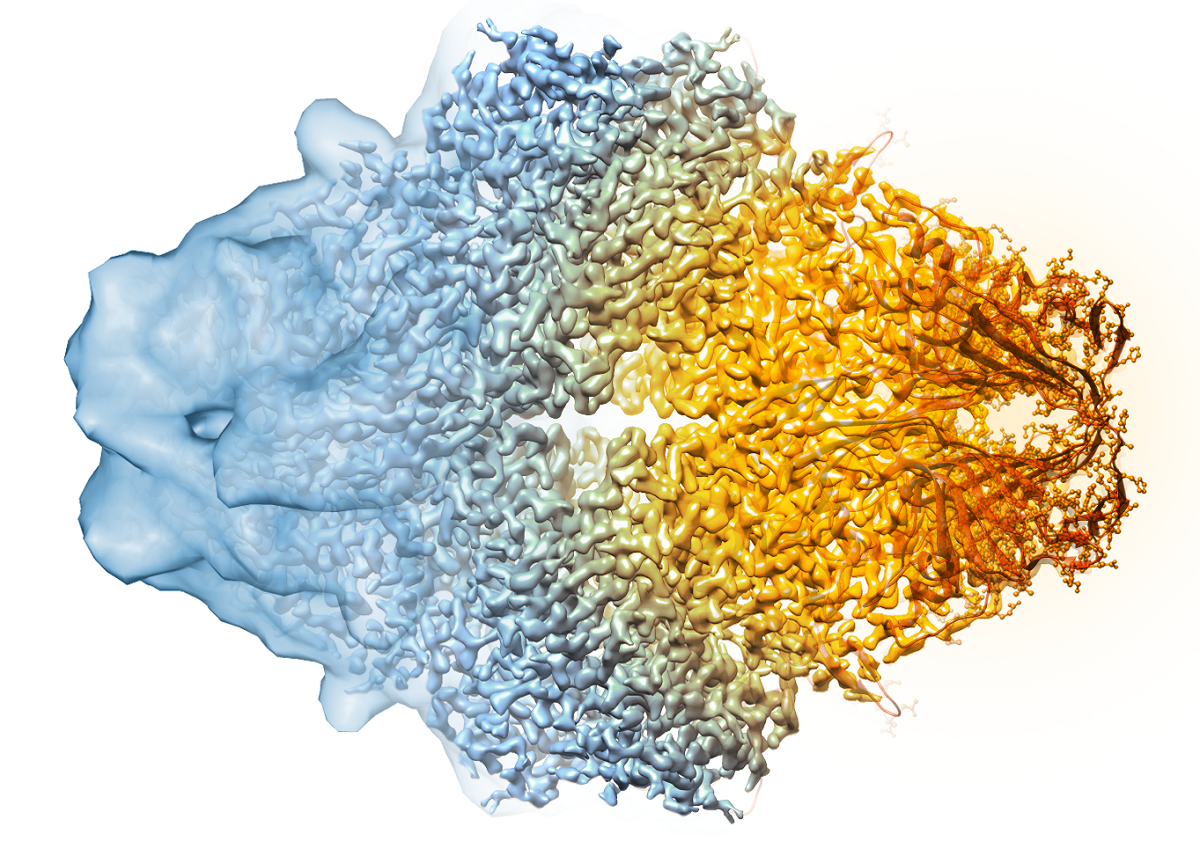 Составное изображение лактазы показывает, насколько резко улучшилось разрешение крио-ЭМ за последние годы. Слева старые изображения, справа — более свежие. Фото: eurekalert.org
Составное изображение лактазы показывает, насколько резко улучшилось разрешение крио-ЭМ за последние годы. Слева старые изображения, справа — более свежие. Фото: eurekalert.org
Крио-ЭМ карты, созданные путем получения множества микроскопических изображений и применения программного обеспечения для обработки изображений, являются важным инструментом для исследователей функций молекул животных, растений, микробов и вирусов.
В последние годы технология крио-ЭМ продвинулась до такой степени, что может создавать структуры с разрешением на атомном уровне для многих типов молекул. Тем не менее, в некоторых ситуациях даже самые продвинутые методы по-прежнему создают модели с более низким разрешением и качеством, чем требуется для выявления деталей сложных химических реакций.
«Усовершенствования, которые предоставляет этот алгоритм, упростят для исследователей определение атомистических структурных моделей на основе данных электронной криомикроскопии. Это особенно важно для моделирования сложных биологических молекул, таких как те, что участвуют в транскрипции и трансляции генетического кода», — рассказывают исследователи.
Алгоритм делает молекулярные карты точнее, фильтруя данные на основе имеющихся знаний о том, как выглядят молекулы, и как наилучшим образом оценить и удалить нежелательный шум в результатах микроскопии.
Команда применила алгоритм к схеме человеческого протеина апоферритина, который, как известно, имеет разрешение в 3,1 Ангстрема (1 Ангстрем равен 10-миллиардной части метра). Затем ученую сравнили свою улучшенную версию с другой общедоступной справочной картой апоферритина с разрешением 1,8 ангстрем и обнаружили улучшения качества и видимости деталей.
То же самое команда применила к 104 наборам схематических данных электронной микроскопии. Практически все результаты показали заметные улучшения.
Авторы отмечают, что явные преимущества алгоритма заключаются в выявлении важных деталей в данных в сочетании с простотой использования — это автоматический анализ, который может выполняться на процессоре ноутбука. Система может стать стандартной частью процесса криоэлектронной микроскопии и продвинуть технологию вперед.
Исследование опубликовано в журнале Nature Methods.
Источник
Полный текст статьи читайте на Компьютерра
