Жесткая вода и накипь. Структура, свойства и способы минимизации ущерба (Steanlab™ Review)
И конечно же — Свободу Алексею Навальному!
Что остается делать темными зимними вечерами в самоизоляции кроме как не перечитывать старые подшивки советских журналов. В зависимости от специализации, у кого-то это журнал Квант, у кого-то Техника Молодежи. В моем случае, из-за профессиональной деформации, подходит только «Химия и жизнь». И вот в одном из номеров этого журнала я натолкнулся на душераздирающее письмо читателя (КДПВ — это оно). И подумал, а ведь действительно, сколько вроде бы не написано на различных сайтах и сайтиках про известковый налет от жесткой воды, а все так же он появляется то в увлажнителях воздуха, то в бойлерах, то даже в радиаторе автомобиля. И все также люди начинают искать ответы, пробуя все подряд рекомендации. Проблема есть (если уж даже Китай тратит 0,2% ВВП страны на борьбу с накипью, в Беларуси 0,5% ВВП тратят на развитие науки и исследований). А если есть проблема, попробуем решить, вложить, используя терминологию читателя ХиЖ «средства в борьбу». Под катом — про жесткую воду, накипь и множество явлений (чаще негативных) которые с этим всем связаны.

Пояснения по тексту. Лонгрид, по сути, компиляция из ранее опубликованных на Patreon заметок, которыми я на протяжении недель терроризировал читателей своего телеграм-канала LAB66, привыкших только к коронавирусным темам. Поэтому встречающейся иногда ссылкой вида [Canonical link] я указываю на заметку, которая была ранее опубликована как отрывок из хабра-черновика.
Для того, чтобы было понятно, почему к.т.н. Л.В. Данилов так волнуется за накипь, в спойлер я спрячу картинку с описанием проблем, к которым накипь может привести и приводит (возможно, кто-то до сих пор с такими проблемами не встречался). Список — далеко не исчерпывающий.

Большинство описанного применимо к быту рядового жителя абсолютно любой из стран (и на Сицилии такие проблемы можно встретить, и в микрорайоне Гомеля). Хотя проблема замечательно масштабируется и на промышленные предприятия (проблемы с трубопроводами/котлами/арматурой на ТЭС и ТЭЦ), на автотранспорт (радиаторы системы охлаждения двигателя, стеклоомыватели и их арматура), на системы увлажнения и кондиционирования воздуха, на водоподводящее оборудование ферм и теплиц.
Так что не зря, ох не зря волновался советский инженер в 70-х годах… Со многими из его выводов, я, кстати, полностью согласен (например, по поводу включения пункта по борьбе с накипью в инструкцию к электроприборам):

Важное обращение! Если вдруг сам к.т.н. Л.В. Данилов, или его дети/внуки/правнуки вдруг прочитают эту статью — пожалуйста, свяжитесь со мной. Если ваше дедушка/прадедушка жив я был бы очень благодарен, если бы вы поинтересовались, как изменилось его мнение по поводу накипи (если конечно изменилось). Ведь статья «с историей» — х2 от обычной статьи…
В общем, несмотря на кажущуюся простоту, проблема образования накипи актуальна и во многих областях техники до сих пор на 100% не решена. Разбираемся вместе.
1. Intro. С чего все начинается…
Начинается все ожидаемо с воды, с самого распространенного и универсального растворителя на Земле. Из-за своей универсальности (=высокая сольватационная способность) в воде растворяются и газы. А один из наиболее распространенных газов — это углекислый газ, он же диоксид углерода, он же CO2. При подходящем давлении/температуре углекислый газ (он все же кислотный оксид) реагирует с водой с образованием слабой угольной кислоты H2CO3. Растворимость этой кислоты увеличивается при понижении температуры и повышении давления. Любое колебание давления/температуры приводит к тому, что угольная кислота диссоциирует с образованием бикарбонат (~гидрокарбонат) ионов и ионов гидроксония.
Слабые растворы угольной кислоты (именно благодаря ей ощущается кисловатый вкус минеральной воды) проникая из водоносного горизонта в толщи горных пород и различных отложений минералов размывают последние и насыщаются ионами металлов (=выщелачивают), в основном кальция («доноры» — кальцит/мел, гипс) и магния («донор» — доломит). В итоге вся вода поступающая из ручьев, озер и скважин, может рассматриваться как разбавленные растворы бикарбоната кальция Ca (HCO3)2 и бикарбоната магния Mg (HCO3)2. Кстати, дождь, содержащий растворенный «парниковый» диоксид углерода, может также реагировать с карбонатом кальция и уносить уже в толщу почвы ионы металлов. Огромный объем уноса кальция в подземные воды обеспечивают кислотные дожди…
1.1 Про живую и мертвую мягкую и жесткую воду
Логично что неорганические ионы, попадая в воду, изменяют ее свойства. И к этим новым свойствам привыкает все живое. Для того, чтобы оценить примерное количество расстворенных ионов используют термин «минерализация». Общая минерализация (англ. Total Dissolved Solids (TDS) — показатель количества содержащихся в воде растворённых веществ (неорганические соли, органические вещества). Также этот показатель называют содержанием твёрдых веществ или общим солесодержанием.
Содержащиеся в водах природных источников соли металлов ~ катионы кальция Са2+, магния Mg2+, стронция Sr2+, бария Ва2+, железа Fe2+ и Fe3+, марганца Mn2+) именуют общей жёсткостью воды. При этом в природных водах превалирует содержание соединений с кальцием и магнием — сумма концентраций данных элементов значительно больше концентрации всех других представленных частиц и даже их суммарной величины. Поэтому общая жёсткость обычно представляется, как сумма катионов кальция и магния в воде, выраженная в эквивалентных весах. В мало- и среднеминерализованных водах обычно ионы кальция преобладают над ионами магния. С ростом минерализации содержание ионов кальция быстро снижается, и обычно не превышает 1 г/л. Содержание ионов магния в высокоминерализованных водах может достигать нескольких граммов, а в соленых — нескольких десятков граммов. Существует закономерность — при увеличении минерализации соотношения ионов выравниваются.
Наиболее часто упоминаемые разновидности понятия жёсткость — это жесткость временная и постоянная. Первый вид объясняется нахождением в воде гидрокарбонатов кальция Са (НСО3)2 и содержащегося в более незначительных количествах магния Mg (НСО3)2, в редких ситуациях — Fe (НСО3)2. Название «временная» определяется тем, что её можно ликвидировать, осуществив нагрев воды до температуры 60 — 100 °С. Кроме представленных видов выделяют также карбонатный и некарбонатный тип жёсткости. Приведенная ниже картина иллюстрирует наличие каких солей отвечает за тот или иной тип жесткости воды.
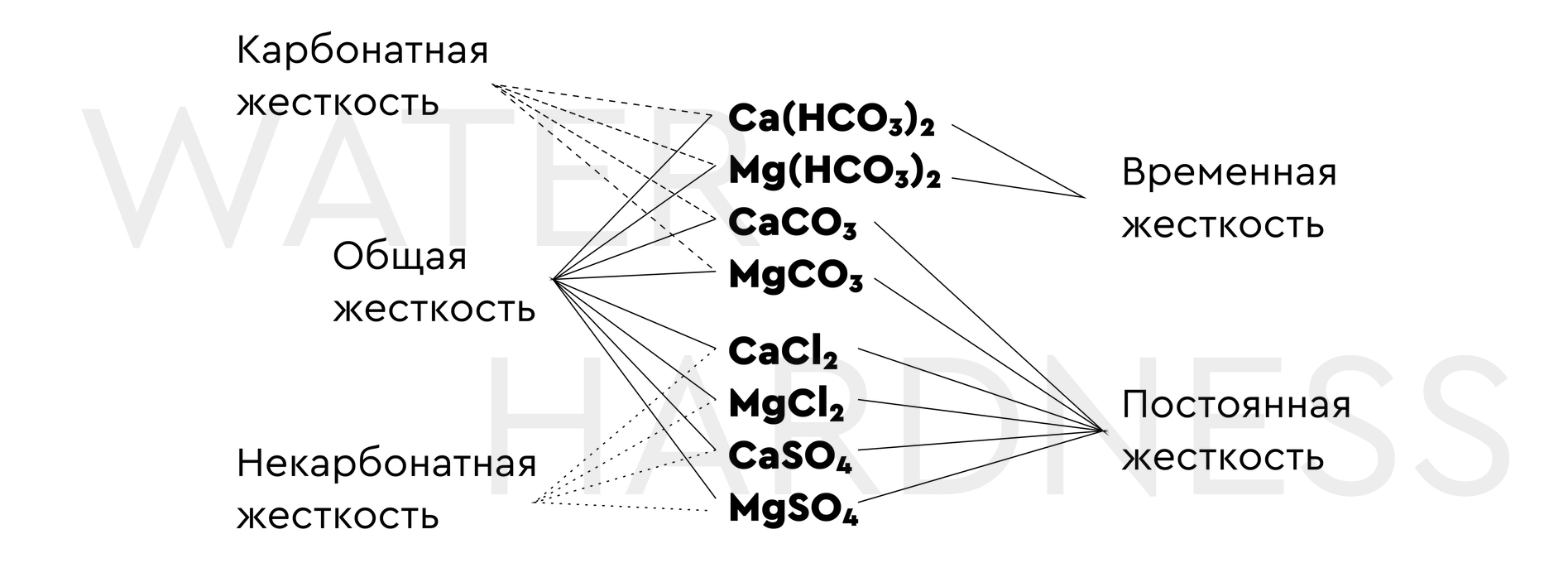
Как уже говорилось, временная жесткость называется временной потому, что может снижаться при нагревании (кипячении) воды за счет перехода растворимых бикарбонатов в нерастворимые карбонаты. Постоянная жесткость кипячением не убирается, хотя сульфаты и фосфаты кальция в определенных условиях также могут кристаллизоваться, образуя отложения на стенках промышленных аппаратов в виде ангидрита, гипса, полуводного сульфата кальция, гидросиликата и гидроксиаппатита. Об этом явлении я остановлюсь отдельно.
Существует еще и следующая закономерность — поверхностная вода обычно имеет меньшую жесткость, поскольку она разбавляется в значительной степени осадками и талыми водами. Этим объясняется и факт сезонных изменений показателей общей жесткости для поверхностных вод (наибольшие значения в конце зимы, а наименьшие — в период паводка). Состав подземных вод более постоянен, меньше изменяется в течение года (особенно артезианских источников) и обычно имеет бОльшие значения, чем у поверхностной воды, по общей жесткости.
Для численного выражения жесткости воды указывают концентрацию в ней катионов кальция и магния. Рекомендованная единица СИ для измерения концентрации — моль на кубический метр (моль/м3), однако, на практике для измерения жесткости используются т.н. «градусы жесткости» и миллиграммы эквивалента на литр (мг-экв/л). В Республике Беларусь и в РФ жесткость воды измеряют в «градусах жесткости» (°Ж), за рубежом приняты другие единицы измерения.
1 °Ж = 1 мг-экв/л = 1 ммоль/ дм3 Са2+ = 20,04 мг; 1 ммоль Mg2+ = 12,16 мг (т.е. в 1 литре воды жесткостью 1 °Ж содержится 20 мг кальция и 12 мг магния).
Что же касается перевода из одного градуса в другой, то существует следующая шкала перевода: 1 °Ж (Беларусь, Россия)= 5,005 °fH (Франция)= 2,804 dGH, °dH (Германия)= 2,924 gpg (США)= 50,05 ppm, mg/L (США)= 3,511 °e, °Clark (Великобритания)
Что же дальше с этим делать — зависит от страны. Градусы измерены, а вот какую воду считать жесткой, какую мягкой — каждый решает для себя. Cм. рисунок под спойлером

взято отсюда
В общем считают, что вода до 2 °Ж — мягкая, от 2–10 °Ж — это вода средней жесткости, а >10 °Ж — это жесткая вода. Более развернутую шкалу используют т.н. «фильтровщики» — специалисты в области фильтрации. По их классификации выходит следующее:
— 0–1,5 мг-экв/л (0–1,5°Ж) — мягкая вода
— 1,5–2 мг-экв/л (1,5–2°Ж)– оптимальная питьевая вода
— 2–5 мг-экв/л (2–5°Ж)– жесткая вода
— 5–7 мг-экв/л (5–7°Ж)– сверхжесткая вода
— > 7 мг-экв/л (> 7°Ж)– не питьевая вода, за пределами рекомендованных значений.
Некоторые diy-исследователи качества питьевой воды советуют при отсутствии специального оборудования и реактивов измерять жесткость воды с помощью «высоты столба пены».
— дистиллированная вода (можно купить канистру на автозаправке)
— хозяйственное мыло (60% или 72%)
— весы (электронные или чашечные с набором грузов) и линейка
— цилиндрический стакан
— литровая банка или прозрачная мерная емкость
1. Отмерьте один грамм хозяйственного мыла и измельчите его (например на электронных весах). Положите мыло в стакан.
2. Нагрейте дистиллированную воду на плите (кипятить не нужно) и аккуратно перелейте в стакан с мылом. Мыло должно раствориться.
3. Долейте в стакан с мыльным раствором еще дистиллированной воды. Если на упаковке мыла указана концентрация 60% долейте до общей высоты жидкости в стакане — 6 см. Если 72% — до 7 см. В каждом сантиметровом слое раствора окажется такое количество мыла, которого достаточно, чтобы связать в одном литре воды все соли жесткости, если их концентрация 1°dH (немецкий градус жесткости). Перевести °dH в мг.экв/л можно по такой таблице:
Градусы dH__Характер воды__Жесткость в мг-экв/л
0–4°__Очень мягкая__до 1,5 мг-экв/л
5–8°__Мягкая__1,5–4 мг-экв/л
9–12°__Средней жесткости__4–8 мг-экв/л
13–22°__Жесткая__8–12 мг-экв/л
23–34°__Очень жесткая__выше 12 мг-экв/л
4. Налейте 0,5 л холодной воды из под крана в банку или мерную емкость.
5. Медленно переливайте мыльный раствор из стакана в банку и плавно помешивайте, пока в банке не появится белая пена. Пена означает, что мыло связало соли жесткости.
6. Измерьте высоту оставшегося в стакане мыльного раствора и вычтите из исходной высоты.

Каждый сантиметр перелитого в банку раствора связал в полулитре водопроводной воды количество солей жесткости, соответствующее 2°dH. Если вы налили в банку 2 см мыла и в вашей воде появилась пена — значит, жесткость вашей воды 4 °dH. Это примерно 1,5 мг-экв/л.
Я предлагаю не спешить и не гоняться за градусами жесткости, а дочитать до раздела, посвященного оценке качества воды. Там и станет понятнее, что воду нужно оценивать комплексно, а не «гнаться за градусом».
1.2 Жесткая вода VS Человек&Машина
Сложно однозначно оценивать такой параметр как влияние жесткости воды на человека, потому что результат будет отличаться в зависимости от того, спроецируем ли мы его на здоровье человека, или же на «здоровье» механизмов и инженерных систем. Рассмотрим каждый пункт в отдельности.
1.2.1. ЧЕЛОВЕК И ЕГО ЗДОРОВЬЕ
И кальций, и магний являются важными биогенными минералами (микроэлементами), необходимыми для функционирования живых организмов (в т.ч. и организма человека). В день человек должен потреблять около 1000 мг кальция и 200–400 мг магния. Если представить, что вы ежедневно выпиваете два литра жесткой воды (или жидкости, произведенной на основе этой воды), то количество полученных таким образом кальция и магния составит 5–20% от нормы. В свете того, что Всемирная организация здравоохранения еще в 2011 году отметила, что не имеется достаточно данных для установления нижних (и верхних) пределов жёсткости воды, можно считать что наличие солей жесткости в воде — это обязательное условие нормальной жизнедеятельности человека. Национальный исследовательский совет США же вообще предложил считать, что жесткая вода служит пищевой добавкой кальция и магния.
Каких либо подтвержденных выраженных влияний жесткости воды на органы и ткани человека пока не существует. Есть различные фрагментарные исследования, которые проведены в определенных регионах и не масштабируются на другие регионы. Можно вспомнить исследования, которые проводились еще в 80-х годах прошлого века в Великобритании, в результате которых было установлено, что при использовании в городах умягченной питьевой водой смертность от сердечно-сосудистых заболеваний на 10–15% выше, чем в местах, где вода средней жесткости (около 170 мг/л). Работы с подобными результатами есть и на примере Франции, Швеции и т.д. В США исследователи связывают употребление жесткой воды с благотворным воздействием на сердечно-сосудистую систему — жесткость отрицательно коррелирует с атеросклеротическим заболеванием сердца.
Добиться гиперкальциемии (превышение содержания кальция в организме) с помощью только употребления жесткой (или даже очень жесткой) воды тяжело. Потому что лишний кальций у здоровых людей выводится через почки, и только нарушение функций почек может поставить здоровье человека под угрозу. Ситуация с магнием похожа: сложно представить, чтобы избыточное количество этого элемента приносило вред человеку со здоровыми почками. Лишь иногда употребление более 250 мг магния в день (для такого количества пришлось бы выпить пять-десять литров очень жесткой воды) производит на здорового человека небольшой слабительный эффект, да и организм через некоторое время к нему адаптируется. Плюс ко всему большая магниевая жесткость придает воде горький привкус (содержание катионов Mg2+ более 100 мг/л) и при всем желании выпить больше чем нужно не получится. В общем, использование воды разной минерализации — вопрос привычки. Жители меловых холмов или те, кто вырос у берега моря, где подземные воды тоже соленые пьют жесткую воду каждый день. НО! Но дело меняется, если в организме возникают болезнетворные микробы, вырабатывающие аммиак (Proteus, Xanthomonas, Pseudomonas, Klebsiella, Staphylococcus и Mycoplasma, куда ж без них…). Тогда поступление высоких доз магния в организм может спровоцировать образование не самого приятного минерала — струвита. Про него подробнее в разделе накипь (-ей).
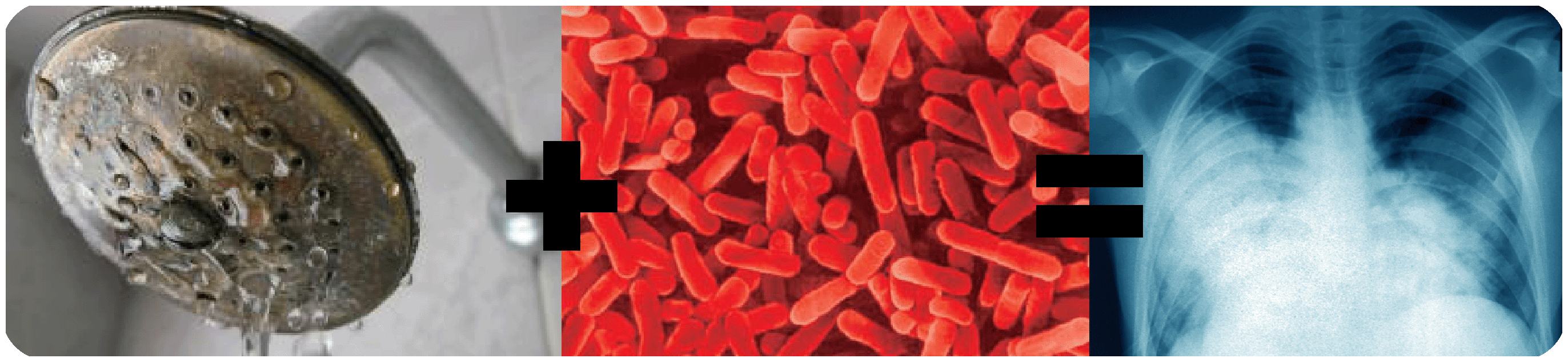
В разделе, посвященному влиянию жесткой воды и последствий ее взаимодействия с человеком хотелось бы упомянуть и про такую вещь как легионеллез. Wikipedia-напомню, что это такое.
Легионеллёз («болезнь легионеров») — острое инфекционное заболевание, обусловленное различными видами микроорганизмов, относящихся к роду Legionella. Заболевание протекает, как правило, с выраженной лихорадкой, общей интоксикацией, поражением лёгких, центральной нервной системы, органов пищеварения, возможно развитие синдрома полиорганной недостаточности <...>
Имеем достаточно суровое заболевание быстро приводящее к смертельному исходу. Первый, наиболее известный случай заражения бактерией легионелла произошел в гостинице «Bellevue-Stratford» в Филадельфии в 1976 году. В этой гостинице проходила встреча около 4500 военных ветеранов из «Американского Легиона», из них 182 человека неожиданно заболели, симптомы болезни были похожи на обычное воспаление легких. Примененные стандартные для такого случая антибиотики оказались неэффективными, и 29 заболевших умерли. Поскольку происхождение болезни было неизвестно, анализировалась в том числе версия покушения на американских военных героев. Прошло немало времени прежде, чем определили, что болезнь вызвана бактерией широко распространенной в природе, которая до сих пор не была выявлена. От названия «Американский легион», в котором служили жертвы и у которых первый раз обнаружили бактерию, ее назвали «Legionella pneumophila», а болезнь, которую она вызывает «легионеллез».
Самая масштабная в Европе эпидемия легионеллеза, известная до настоящего времени, имела место в апреле 1985 года в Главной районной больнице в городе Страффорд в Великобритании, где из 101 человека заболевших легионеллезом, умерли 28. В обоих случаях, как доказано позже, причиной был кондиционер. Источником заражения стал биоаэрозоль, содержавший бактерии легионеллы, который поступал в помещение из системы кондиционирования.
Из всего множества разновидностей легионеллеза достаточно распространенный вариант — это понтиакская лихорадка, или лихорадка Понтиак. Основное отличие этой клинической формы в том, что она протекает без развития пневмонии и похожа на обычный грипп. Выздоровление, как правило происходит спонтанно и поэтому болезнь часто не диагностируется. Инфекция, вызванная легионеллой, не передается от человека к человеку, хотя один возможный случай был зарегистрирован.
Решил я упомянуть про это заболевание потому, что оно косвенно связано с жесткой водой и прямо — с образующейся из жесткой воды накипи. С расширением хозяйственной деятельности человека легионеллы, помимо естественной среды обитания получили в подарок искусственную — созданную человеком. Это все водные системы, где циркулирует вода оптимальной температуры. Что является оптимальным температурным диапазоном — см. таблицу ниже:
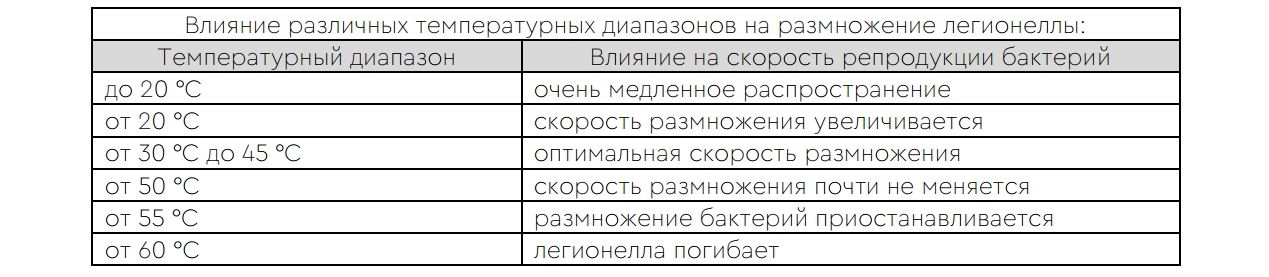
Легионеллы размножаются в теплой стоячей воде. Они могут умеренно размножаться в воде с температурой от 20 до 45 °C и буйствовать в воде диапазона 32–44 °C. При температурах выше 50 °C рост приостанавливается, а при 70 °C бактерия погибает практически мгновенно. В естественных условиях такие температурные диапазоны редки. А вот в искусственных встречаются очень часто в системе горячего водоснабжения, в душевых и ванных комнатах, в банях, в бассейнах с гидромассажем, резервуарах с горячей водой и испарительных конденсаторах систем кондиционирования воздуха. Условия для размножения появляются потому что возникает дилемма — с одной стороны, вода 45–50 °C наиболее комфортна для мытья, а с другой — обеспечивает лучшие условия для развития легионеллы.
Восприятие температуры воды человеком взято из работы G. Brundrett Legionella and building services (1992):
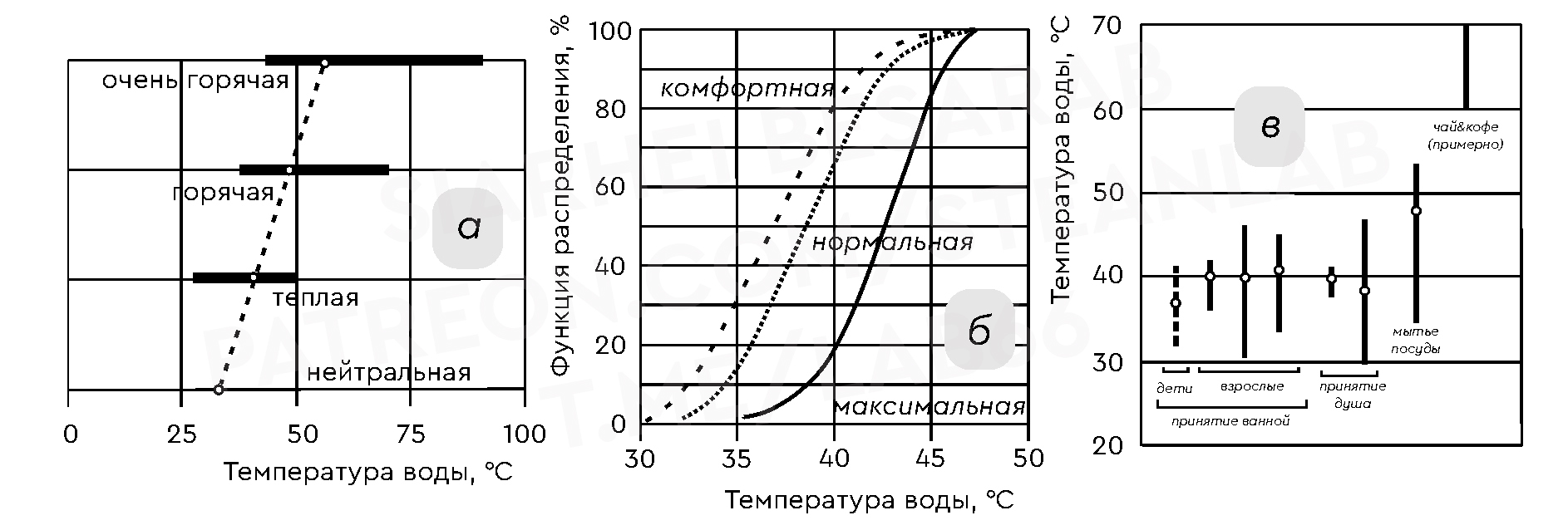
где, а — субъективное восприятие домохозяйками температуры воды (проверка путем погружения рук), б — теплоощущение человека при принятии душа (на примере взрослых мужчин), в — типичное предпочтение потребителем температуры горячей воды.
Т.е. мы имеем налицо противоречие, с одной стороны нужно попасть в предпочитаемый большинство жителей температурный диапазон, с другой — не дать развиться легионеллам. Европейские производители бойлеров и водонагревателей стараются делать так, чтобы температура воды хотя бы иногда поднималась выше 55–60 °C и пастеризовала все оборудование от легионеллы. В посудомоечных машинах как правило температура выдерживается на уровне 55 °C, повышение до 60 °C вызывает усиленное осаждение известковых отложений (об этом ниже), а температуры выше 70 °C в присутствии агрессивных компонентов моющих смесей могут привести к повреждению покрытий посуды.
Наибольшую опасность с точки зрения образования биоаэрозолей легионеллы представляют душевые кабины, бани типа турецких, общественные душевые в общежитиях и т.п… На рисунке показан механизм заражения:

Сначала легионеллы размножаются в трубах, колонизируя простейших (амебы и т.п.) или биопленки/минеральные отложения (А). Затем связанная с биопленкой легионелла во время принятия душа смещается током воды из трубы в душевую лейку (B) и превращается в биоаэрозоль (С). Ну, а биоаэрозоль вдыхается (D) и оседает в альвеолах легких человека (Е).
В трубы водоснабжения легионеллы могут попадать разными путями, чаще всего с простейшими (амебы, лямблии и т.д.) или их цистами (пункт 1 на рисунке ниже).
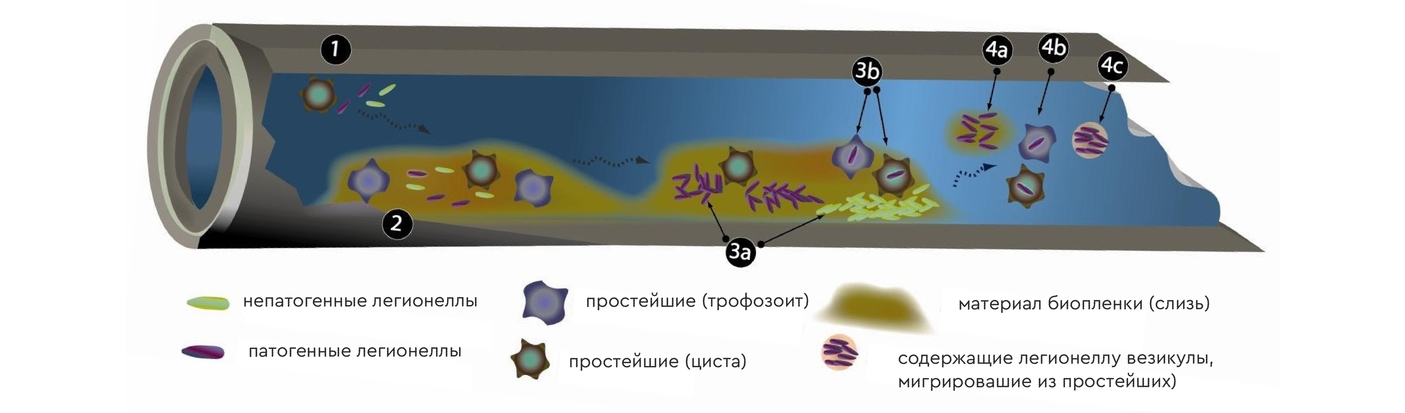
Попав в водопроводные трубы простейшие адсорбируются на известковых отложениях и/или покрывающих их биопленках (слизи) — пункт 2 на рисунке. Патогенные легионеллы могут образовывать собственные колонии внутри труб (пункт 3а) либо попадать в организм простейших (3b). После попадания в организм носителя легионелла может либо уничтожить своего носителя, либо вместе с носителем попасть в цисты. Трансфер из биопленки в водопроводную воду также может происходить разными путями, например за счет уноса биопленок током воды (4а). Там бактерии могут присутствовать как в виде цист простейших (4b), либо в виде т.н. репликационных вакуолей организма-носителя (4с). После уноса потоко воды этот «бактериальный материал» может либо попасть в питьевую/хозяйственную воду к человеку, либо же образовать колонии дальше по течению воды в трубопроводе. Колония может образоваться не только в душевой лейке, но и в аэраторе крана, в мойке и т.п.
В общем любая система где имеется а)вода температурой от 20 до 50 градусов, б)имеется подходящая биопленка с твердой минеральной матрицей (накипь в виде известковых или других инертных отложений) и в)имеется возможность диспергирования капель воды до состояния аэрозоля — любая такая система может в потенциале служить источником заражения человека легионеллезом. Легионелла высеивается из жидкостей кондиционеров, промышленных и бытовых систем охлаждения, бойлерных и душевых установок, оборудования для респираторной терапии (CPAP), увлажнителей воздуха, спа-бассейнов/джакузи. Так что при случае следует проверить увлажнители воздуха/душевые лейки на наличие накипи/биопленок (слизи) и провести соответствующую обработку.
Про обработку для борьбы с накипью мы будет еще говорить дальше, а вот на биопленке/слизи в увлажнителях воздуха, парогенераторах, генераторах пара для бань типа «хамам» я скажу сейчас. Упомянутые выше предметы требуют обязательного регулярного удаления биопленок (слизи). Добиться уничтожения и бактерий и простейших и грибов можно проверенными средствами — перекисью водорода (см. статью Про перекись водорода и жука-ракетчика) и гипохлоритом натрия (см. статью Что в Белизне тебе моей или Справочное пособие по гипохлориту натрия («хлорке»)). Но в отличие от душевой лейки, которая просто может прекратить работать, потому что забилась слизью и накипью, тот же увлажнитель воздуха разбирать и дезинфицировать владельцы почему-то не спешат. В таком случае можно посоветовать каждый раз, заправляя это устройство водой добавлять туда пару капель средства, препятствующего биообрастанию. Часто используется раствор метиленовой сини («синька») или бриллиантового зеленого («зеленка»), но если при наружном использовании эти вещества не оказывают никакого вредного действия, то вот мнения насчет того, как эти красители взаимодействуют с легкими в аэрозольной форме пока разнятся.
Я лично, до выяснения всех причин, решил не рисковать. Одно время для ингибирования биообрастания активно использовались соли серебра/меди (например добавка в каждую «заправку» увлажнителя по пару капель раствора медного купороса (~сульфат меди) или нитрата серебра (~ляпис). Обрастание действительно снижалось на порядки (но! не полностью), увеличивать же дозу не хотелось ибо не известно как аэрозоли тяжелых металлов будут взаимодействовать с легкими. В итоге все же скрепя сердце пришлось раз в неделю проводить «прогревание» деталей увлажнителя в закипевшей воде (т.е. 60 °C Общепринятым мнением является мнение о том, что на мыле ничего жить не может, и распространять инфекцию оно так же не может. Но в пример хотелось бы привести интересную статью, в которой исследователи проверили мыло общего пользования из 18 различных стоматологических клиник на предмет бактериального обсеменения. Оказалось, что кусок мыла — это целая вселенная, на котором может обитать до 8 различных родов микроорганизмов (грамположительные и грамотрицательные бактерии, аэробные бактерии, анаэробные бактерии и грибы. Фактически, кусок мыла в общественном месте — это аккумулятор микрофлоры (или «зоопарк», как кому приятнее воспринимать) — сводится на нет вся цель мытья рук и увеличивается риск перекрестного заражения. Наверное поэтому и CDC и ВОЗ чаще всего в своих рекомендациях, касающихся мытья рук, рекомендуют использовать жидкое мыло, в специальных дозаторах, препятствующих накоплению микрофлоры и ее трансферу (локтевые дозаторы и т.п.). Можно использовать также одноразовые мыльные таблетки или хирургические скрабы. Дополнительно, на случай комментария «так то мыло в поликлинике, дома то все иначе» — приведу в пример статью в которой была проанализирована микрофлора кускового мыла, используемого в домашних условиях. Оказалось, что на влажном, часто используемом мыле бактерий живет гораздо больше, чем на мыле сухом, редко используемом. Основными выделенными бактериями были стафилококки и энтеробактерии. Так что повара-шаурмисты, которых уволили из минской школы где произошло массовое отравление детей шаурмой, могли быть и не виноваты. Нужно просто было использовать вместо общего хозяйственного мыла жидкое да в дозаторе.
1.2.3 ВЛИЯНИЕ ЖЕСТКОЙ ВОДЫ НА КОЖУ [Canonical link — Жесткая вода и кожа]
В народе (и у копирайтеров-косметологов) считается, что сыпь, зуд, сухость, шелушение может образовываться из-за образования нерастворимых стеаратов кальция/магния и осаждения их на коже. Потом из-за этого кожа не только преждевременно стареет, но и становится чувствительной к раздражениям и расположенной к аллергическим реакциям. Также из-за гиперчувствительности к стеаратам некоторые специалисты связывают употребление жесткой воды в домашних условиях с повышенной экземой у детей.
Некий смысл в этом безусловно есть, т.к. действительно, жесткая вода взаимодействует с традиционным мылом, т.е. натриевыми солями стеариновой/пальмитиновой кислот. В результате образуется белый осадок («мыльный камень») вместо образования пены. Основным компонентом такой накипи является стеарат кальция, поменьше стеарата магния.
2C17H35COO- + Ca2+ → (C17H35COO)2Ca↓
2C17H35COO- + Mg2+ → (C17H35COO)2Mg↓
Лайфхак на заметку:, но несмотря на все выше сказанное, основной компонент «мыльного камня» — стеарат кальция — является зарегистрированной пищевой добавкой E470. Это раз. А два — напомню, что именно стеараты являются прекрасными смазками (стеарат лития, например — это литиевая смазка, литол по-нашему). Так что никто не мешает не раздражаться по поводу «мыльного камня», а собрать его да смазать петли в ванной :) В мировом масштабе стеарат кальция используется как смазка в карандашах и мелках, при производстве бумаги (предупреждает пыление и растрескивание) и т.п.
После минутки занимательной науки не грех перейти и к основам биохимии&физиологии и показать, что не все так и просто. Знания понадобятся для того, чтобы объяснить как жесткость воды воздействует на кожу и волосы. Два этих объекта объединены в один подпункт потому, что с точки зрения химика близки по своему химическому устройству (=состоят из белка кератина). Правда кератиновой кожа становится только в самом своем верхнем слое («ороговевшая», аля т.н. «натоптыши» или мозоли), после того, как закончился процесс эпителиальной дифференциации. Это важный процесс, его нужно взять на заметку. Чтобы было проще понять его важность — напомню, как устроен верхний защитный слой кожи у человека (см. картинку).

В «стене» человеческой кожи существует несколько слоев. Первый — «фундамент» — это базальный слой. Он состоит из цилиндрических кератиноцитов и межклеточного пространства, в котором циркулирует лимфатическая жидкость. В этом слое за счет «профориентации» стволовых клеток в кератиноциты происходит регенерация эпидермиса.
За базальным слоем следует шиповатый (или остистый) слой. Кератиноциты здесь кубические, уплощающиеся к периферии. Клетки связаны между собой через межклеточные связывающие элементы — десмосомы (если вспомнить про аналогию с кирпичной стеной, то десмосомы — это прутья арматуры). В этом слое формируются первичные фрагменты кератиновых нитей (из них в конце концов образуются роговые чешуйки отшелушивающейся кожи). За шиповатым слоем следует слой зернистый.
Зернистый слой — это один или два ряда кератиноцитов (на ладонях и подошвах — до семи), овальной формы, расположенных параллельно поверхности кожи. Важность слоя заключается в том, что именно здесь содержатся кератиносомы, или ламеллярные гранулы (гранулы Одланда). Они содержат различные липиды (если вспомнить аналогию с кирпичной стеной, липиды — это цемент), которые высвобождаясь в межклеточное пространство, придают коже гидрофобность, препятствуя потере влаги. Кроме липидов здесь синтезируются и основные кожные белки — кератин, лорикрин, филаггрин, инволюкрин и кератолинин. Белок филаггрин выступает в роли базы, на которой агрегируются нити кератина. А уже к полученному композиту присоединяются белки, полисахариды, липиды, аминокислоты, которые высвобождаются при начинающемся здесь распаде ядер и органелл. Этот «коктейль» имеет свое название — кератогиалин. Гранулы этого соединения и придают кератиноцитам данного слоя зернистый вид.
Над зернистым слоем располагается блестящий слой. Здесь у кератиноцитов практически полностью разрушается ядро, клеточные органеллы и десмосомы, связывающие клетки между собой. Плоские «неживые» кератиноциты которые начинают формироваться в блестящем слое называются корнеоцитами. С переходом от блестящего к последнему, роговому слою, кератиноциты полностью заполняются продольно расположенными кератиновыми фибриллами, спаянными смесью филаггрина с липидами из гранул Одланда и смещаются в наружный роговой слой.
Ну и наконец Его Величество Роговой слой кожи. Слой, который в прямом смысле слова открыт миру. Толщина слоя на ладонях и подошвах достигает 6
