Штурм и натиск генной терапии старения

Экспрессия генов и генная терапия
Концепция генной терапии существует на протяжении последних двадцати-тридцати лет. Она заключатся в том, что наиболее радикальный способ борьбы с заболеваниями — это уничтожение самой генетической причины болезни, а не его следствий.
Причиной может быть нарушение определенного гена (мутация), которое передалось от родителей при наследственных заболеваниях, или мутация гена уже во взрослом организме, вызывающая, например, рак. Кроме того, причиной может являться просто слишком высокая (или, наоборот, низкая) активность нормального гена, которая увеличивает риск хронического заболевания, такого как диабет или атеросклероз.
Способ борьбы с этими изменениями заключается во введении в клетку новой генетической информации, призванной исправить ту, с которой связана болезнь.
Вначале немного углубимся в теорию. Молекула ДНК — дезоксирибонуклеиновая кислота — является носителем кода, который управляет развитием и функционированием всего живого. В ДНК содержится программа, которая обеспечивает превращение одной единственной исходной клетки в слаженно работающий организм, состоящий из многочисленных клеток, объединенных в разнообразные ткани и органы.

Расшифровка структуры ДНК в 1953 году стала одним из поворотных моментов в истории биологии. За это открытие ученым Джеймсу Уотсону, Фрэнсису Крику и Морису Уилкинсу была присуждена Нобелевская премия по физиологии и медицине 1962 года.
ДНК — огромная молекула, которая состоит из тысяч маленьких молекул — нуклеотидов, четырех разных типов: гуанин (G), цитозин ©, тимин (T) и аденин (A). Нуклеотиды соединяются друг с другом, образуя цепочку; молекула ДНК состоит из 2х таких цепочек, закрученных в двойную спираль.

При соединении 2х цепей выполняются следующие правила: аденин всегда соединяется с тимином, а гуанин — с цитозином. Таким образом, напротив тимина из одной нити всегда будет находиться аденин из другой.
Такое расположение позволило объяснить механизмы копирования ДНК при делении клетки. Две нити спирали расходятся, а затем к каждой из них достраивается точная копия ее бывшей «партнерши» по спирали. По такому же принципу, как с негатива в фотографии печатают позитив.
Следующая революция в изучении ДНК произошла спустя 50 лет, в 2003 году, когда был завершен огромный проект «Геном человека». Он позволил расшифровать все 19 000 генов нашего организма и открыл небывалые возможности для медицины.

Ген — это участок молекулы ДНК, в котором закодирован полипептид (часть молекулы белка) или функциональная РНК. Длиной он, как правило, в несколько сотен нуклеотидов, но бывают и исключения. Самые маленькие гены человеческого генома — гены транспортных РНК — составляют всего 76 пар нуклеотидов, а самый большой ген — ген белка дистрофина — 2,4 млн.
У наиболее развитых организмов, в том числе и человека, гены часто бывают разделены фрагментами «бессмысленной», некодирующей ДНК. ДНК человека обвернута вокруг молекулярного остова из белков, вместе с которым она образует хромосому. Вся ДНК человека помещается в 46 хромосомах.
Если сравнить клетку с заводом, то ДНК будет чем-то вроде информации с жесткого диска, хранящейся в канцелярии завода. Чтобы завод начал работать, эту информацию необходимо транслировать на все устройства в цехах завода — эту роль в клетке выполняют рибонуклеиновые кислоты — РНК. И, наконец, продукция, которая начинает собираться в цехах завода по этой программе — это клеточные белки.
Процесс считывания информации с ДНК получил название «экспрессия генов».

Если ДНК — это закодированная информация обо всех процессах организма, то белки — основные исполнители и контроллеры этих процессов. Существует огромное количество разных классов белков, принимающих участие во всех важных для организма процессах.
Существуют белки, которые укоряют протекание химических реакций в организме; выполняют строительную функцию — как своего рода арматура придают форму клеткам и их частям; защищают организм, обезвреживая токсины, патогенных бактерий и вирусов; регулируют считывание информации с ДНК и синтез соответствующих белков.
Также есть белки, которые передают сигналы между клетками, тканями и о́рганами, транспортируют различные молекулы по клеткам и разным системам; в белках запасается энергия; белки являются рецепторами — запускают каскад клеточных событий в ответ на определенные сигналы из внешней среды или из внутренних систем организма; они могут выполнять моторную функцию — обеспечивают движения организма, например, сокращение мышц.

Генная терапия — это вмешательство в работу клеточного «завода» по производству белков. Она позволяет, как активировать работу нужных генов, так и «выключать» вредные. В первом случае в клетку доставляют ген, с которого начинает считываться белок, необходимый для терапии заболевания. А во втором — в клетку вводятся регуляторные РНК, которые блокируют экспрессию «вредного» гена.
Чаще всего блокировка генов достигается за счет того, что в клетку доставляют малые интерферирующие РНК (миРНК), которые связываются с РНК гена, который нужно «выключить». Связывание миРНК и РНК блокирует синтез белка и в конечном итоге приводит к деградации РНК.
Этот процесс носит название интерференции РНК. Он был открыт в 1998 году американскими учеными Эндрю Файер и Крейг Мелло и был признан настолько важным, что уже в 2006 году была вручена Нобелевская премия в области физиологии и медицины за его открытие.
Генная терапия: успехи и тенденции
Генная терапия возникла более 25 лет назад. Первое успешное клиническое исследование (на людях) было проведено в 1989 по генной терапии тяжелого комбинированного иммунодефицита. В настоящий момент генная терапия бурно развивается.
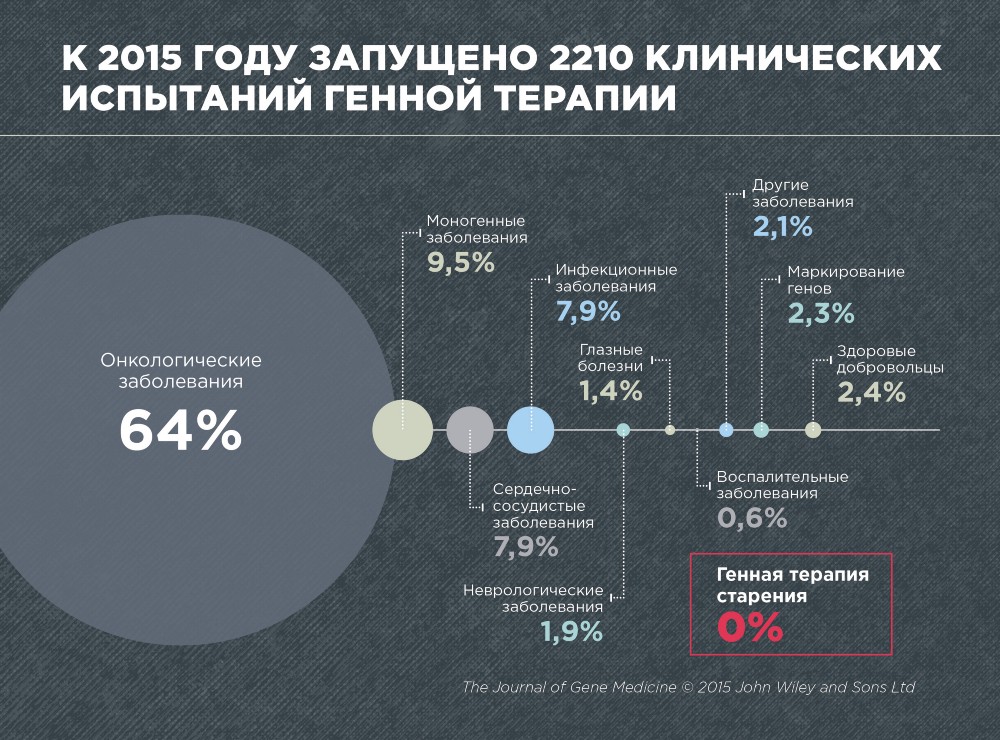
По данным журнала Gene Medicine, в 2015 году было проведено 2210 клинических испытаний по генной терапии различных болезней. Это, преимущественно рак (64%), моногенные заболевания, вызванные мутацией в одном гене (9,5%), сердечно-сосудистые (7,9%) и инфекционные (7,9%).
По генной терапии старения не проведено ни одного клинического испытания, что неудивительно, поскольку старение до сих пор не признано болезнью. Кроме того, генная терапия старения пока еще очень молодая и развивающаяся область.
Для ряда заболеваний генная терапия оказалась вполне успешной. Среди них наследственные заболевания иммунной системы — тяжелый комбинированный иммунодефицит, синдром Вискотта-Олдрича и хроническая гранулематозная болезнь; наследственная болезнь, связанная с нарушением обмена веществ — адренолейкодистрофия; наследственное заболевание сетчатки — амавроз Лебера и некоторые формы рака.
К настоящему времени уже 4 генотерапевтических лекарства допущены к продаже. В Китае в 2003 году выпущен «Гендицин» (Gendicine) — препарат для лечения плоскоклеточного рака головы и шеи на основе гена p53, а в 2006 — «Онкорин» (Oncorine) — онколитический вирус для лечения назофарингеальной карциномы. В Европе в 2012 году запущено производство препарата «Глибера» (Glybera), предназначенного для терапии наследственного дефицита липопротеинлипазы (ЛПЛ) путем доставки одноименного гена. А в России допущен к продаже препарат «Неоваскулген» для лечения заболеваний периферических артерий. Он представляет собой ген VEGF (фактора роста эндотелия сосудов).
Основная проблема генной терапии — как доставить терапевтический ген (или РНК) в клетки-мишени. Обычно для этого используют векторы для доставки — переносчики генетических конструкций. Они не позволяют ДНК разрушиться в крови, обеспечивают выход ДНК из капилляров (мелких кровеносных сосудов) в ткани и проникновение внутрь клеток и в клеточное ядро.
Чаще всего в качестве векторов используют вирусы, поскольку они обладают очень эффективными — отточенными эволюцией — механизмами проникновения в клетки животных. Инфицируя клетку в природе, вирус доставляет свой генетический материал в ядро этой клетки и начинает воспроизводиться и нарабатывать свои белки, используя механизмы экспрессии генов клетки хозяина.
Ученые упростили вирусы, убрав из них гены, вовлеченные в патогенез и вызывающие иммунный ответ организма, и превратили в векторы для доставки генетического материала.
 Наиболее популярными вирусами, используемыми в генной терапии, являются аденовирусы (их применяют в 22,2% клинических исследований), а также — ретровирусы (на их долю приходится 18,4% работ). Только набирают популярность более новые векторы — аденоассоциированные вирусы (6% клинических испытаний) и лентивирусы (5% исследований).
Наиболее популярными вирусами, используемыми в генной терапии, являются аденовирусы (их применяют в 22,2% клинических исследований), а также — ретровирусы (на их долю приходится 18,4% работ). Только набирают популярность более новые векторы — аденоассоциированные вирусы (6% клинических испытаний) и лентивирусы (5% исследований).
Самыми перспективными для генной терапии представляются аденоассоциированные (AAV) и лентивирусные векторы. Первые позволят доставить генетическую конструкцию в организм системно (то есть в ряд тканей и органов) без побочных эффектов. Правда, они не встраивают генетический материал в геном, так что доставленный ген со временем может теряться.
Если же необходимо обеспечить высокую эффективность доставки и встраивание доставляемой конструкции в геном, следует применять лентивирусные векторы. Однако они не подходят для системной доставки и применяются для локального введения в небольшой участок ткани или — в клетки в пробирке. Кроме того, они могут вызывать побочные эффекты из-за встраивания в нежелательные места генома (например, в протоонкогены и вызывать рак).

Использование технологии редактирования генома CRISPR/Cas9 открывает новые возможности в генной терапии. CRISPR/Cas9 позволяет очень точно и безопасно изменять ДНК клеток. И если совместить технологию CRISPR/Cas9 с доставкой при помощи аденоассоциированных вирусов, то это, по-видимому, позволит системно воздействовать на организм и совершенно безопасно изменять геном очень большого числа клеток. То есть ее использование позволяет совместить достоинства, как аденоассоциированных, так и лентивирусных векторов.
В природе эта система имеется у бактерий и архей. Она используется для защиты от бактериофагов (вирусов бактерий) или других чужеродных генетических элементов. В случае заражения клетки система CRISPR/Cas узнает последовательности чужеродной ДНК и разрезает ее. Впервые система CRISPR/Cas была обнаружена еще в 1987 году, однако ее функции стали активно изучаться, только начиная с 2005 года.
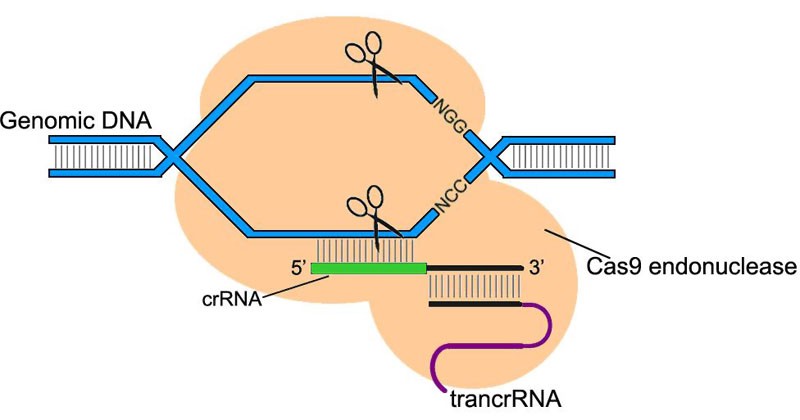
Поскольку CRISPR/Cas сверхточно узнает и разрезает ДНК, ученые решили приспособить ее для редактирования генома млекопитающих. Использование CRISPR/Cas превзошло все ожидания. Она позволила с минимальным числом ошибок как «выключать» нужные гены, так и встраивать новые гены в строго определенные участки генома.
Система CRISPR/Cas9 состоит из эндонуклеазы Cas9 — фермента, разрезающего ДНК, и направляющей РНК, связывающаяся только со строго определенной геномной последовательностью. Такая система позволяет найти и разрезать участки генома в нужном месте, нацеливаясь на них направляющей РНК.
Направляющая РНК подбирается исследователями самостоятельно, так что можно нацелить систему CRISPR/Cas9 на любой нужный участок генома.

А совсем недавно, в декабре 2015 года научная группа Фенга Джанга видоизменила данную систему так, что она стала и вовсе безошибочной, что было опубликовано в ведущем научном журнале Science. Ученые заменили 3 аминокислоты («кирпичика», из которых состоит белок) в эндонуклеазе Cas9, после чего число ошибок такой системы свелось практически к нулю.
Использование CRISP/Cas9 особенно актуально для генной терапии старения, где требуется воздействовать на пути долголетия, общие для большинства клеток организма.
Важной особенностью этих вирусов является то, что они не встраивают доставляемые гены в геном. Правда, в случае аденоассоциированных векторов все же показано, что <1% случаев происходит встраивание (интеграция) в определенный район генома хозяина.
Отсутствие случайной интеграции гена в геном — большой плюс в плане безопасности этих векторов. В этом случае нет риска, что ген случайно встроится в последовательность протоонкогена и вызовет рак. С другой стороны, если ген не встроился в геном, он может со временем теряться, например, при делении клеток. Поэтому терапевтический эффект в случае использования таких векторов может быть временным.
Хотя аденовирусы пока применяются в генной терапии гораздо чаще, аденоассоциированные вирусы являются гораздо более перспективными, в связи с большей безопасностью. Дело в том, что при введении в организм — аденовирусы могут вызвать сильный иммунный ответ и воспалительную реакцию.
На ранних этапах развития генной терапии использование аденовирусных векторов даже привело к смерти пациента. Джесси Джелсинджер страдал от дефицита орнитин-транскарбамилазы — генетического заболевания печени. В 18-летнем возрасте он принял участие в клиническом испытании по генной терапии, и умер из-за системного воспалительного ответа в ответ на введение вирусной конструкции.
Напротив, введение аденоассоциированных вирусов в организм приводит только к незначительному иммунному ответу, поскольку в природе эти вирусы не вызывают болезней млекопитающих и почти не узнаются иммунной системой человека.
Другие вирусные векторы — ретровирусы и лентивирусы — встраивают генетический материал в геном и обеспечивают стабильный терапевтический эффект. Однако случайная интеграция в геном может привести к активации раковых механизмов, что уже произошло несколько раз в истории генной терапии.
Ретро- и лентивирусы используются почти исключительно для узконаправленной доставки в определенные ткани и их участки, или же — в клетки в пробирке, поскольку в отличие от AV и AAV они переносят материал на гораздо меньшие «расстояния». Недостатком ретровирусов является то, что они способны проникать только в делящиеся клетки. Поэтому гораздо более перспективны лентивирусы, так как они инфицируют и неделящиеся клетки тоже.
Кроме того, в генной терапии довольно часто используют невирусные способы доставки ДНК и РНК, например, липосомы. Они сильно уступают вирусным векторам по эффективности, однако более безопасны и дешевы.
 Сравнительный анализ векторов доставки генетического материала в клетку
Сравнительный анализ векторов доставки генетического материала в клетку
Состояние и перспективы генной терапии старения
В данный момент генная терапия старения бурно развивается, однако пока все еще находится на доклинической стадии развития (то есть, экспериментов на людях пока не проводилось). Среди 2210 клинических испытаний по генной терапии, запущенных к сегодняшнему дню, нет ни одного для лечения старения. Отчасти это связано с юридическими моментами: старение до сих пор не считается заболеванием. Но и сама эта область исследований возникла очень недавно. Первые работы по генной терапии старения на мышах были проведены менее 5 лет назад.
Сейчас все исследования по генной терапии старения проводятся на модельных мышах, крысах, обезьянах и клеточных культурах человека — клетках в пробирке.
Все подходы к генной терапии старения делятся на те, где в организм доставляется ген долголетия, и на те, где вводятся малые РНК, «выключающие» ген или путь старения. То есть в первом случае вводится нечто полезное для долголетия, а во втором — отключается вредное.
В строгом смысле исследований по генной терапии старения на млекопитающих было проведено только два. В этих работах мышам вводили терапевтический ген и смотрели, как это подействовало на старение и продолжительность жизни. Первая работа была проведена группой Марии Бласко в 2012 году, в которой удалось продлить жизнь мышам на 20%. А вторая — это терапия гипоталамуса геном ингибитора NF-kB, которую Доншенг Кай с коллегами провел в 2013-ом. В ней жизнь мышей увеличилась на 10%. Обе работы очень обнадеживают: терапия была очень эффективной и без каких-либо побочных эффектов.

Гораздо больше работ моделируют генную терапию на трансгенных мышах. В таких исследованиях терапевтический ген не доставляют в организм взрослой мыши, а при помощи генной инженерии создают мышей, геном которых изменен с рождения. Как и генная терапия, это позволяет исследовать, как увеличение или снижение активности разных генов влияет на продолжительность жизни и старение организма.
Есть очень много исследований, где генную терапию старения моделируют на клеточных линиях. В таких работах обычно смотрят, замедлит ли доставка терапевтического гена старение клеток в пробирке или нет. Но этот подход дает неоднозначные результаты, поскольку терапия, которая продлевает жизнь клеткам, далеко не всегда продлевает жизнь организму и наоборот. Например, повышенная активность гена долголетия и ответа на стресс FOXO продлевает жизнь модельным дрозофилам. А в экспериментах на стволовых клетках кожи клеточное старение замедлялось, когда ген FOXO3, наоборот, «выключали».
В настоящее время подходы генной терапии разрабатываются в отношении всех основных механизмов долголетия, известных на сегодняшний день: увеличение стабильности генома, омоложение гипоталамуса, уничтожение сенессентных клеток, увеличение устойчивости к стрессам, улучшение работы митохондрий и поддержание ниш стволовых клеток.
Однако гораздо больше исследований проводится по генной терапии отдельных возраст-зависимых патологий, например возрастное истощение мышц и ухудшение когнитивных способностей. Сами по себе они не являются заболеваниями, однако ухудшают качество жизни и могут приводить к тому, что увеличивается риск многих возрастных болезней.
Всего было проведено около 46 работ по генной терапии возраст-зависимых патологий на модельных крысах, мышах и даже обезьянах. Это работы по генной терапии в «классическом смысле»: модельным животным (чаще всего — старым) вводили ген в составе вектора для доставки. А после терапии анализировали, как это повлияло на возникновение возрастной патологии. К сожалению, в подавляющем большинстве таких работ не смотрели на побочные эффекты.
Больше всего исследований было посвящено патологиям центральной нервной системы — примерно 10 работ. На нарушения работы сердца и сосудов — приходится 6 исследований, на нарушения половой системы — 7, патологии хряща — 6, ожирение — 4, нарушения костной ткани — 7, зрения — 3, иммунной системы — 3 и мышц — 1 работа.
В заключение, хочу отметить, что, несмотря на то, что по генной терапии старения проведено сравнительно немного экспериментов с максимальным эффектом продления жизни — 20%, она уже обладает огромным преимуществом, по сравнению с другими подходами к продлению жизни (например, геропротекторами или ограничением питания, продлевающими жизнь до 30–50%). Генную терапию достаточно провести только один раз за всю жизнь!
Например, в работе Андржея Бартке 2001 года ограничение питания продлило жизнь мышам на 30%. Однако мыши употребляли низкокалорийную диету до 670 дней подряд — то есть каждый день, в течение половины своей жизни! А в эксперименте по генной терапии Марии Бласко 2012 года генная терапия теломеразой привела к немного меньшему эффекту — мыши стали жить дольше на 20%. Однако в этой работе мыши получили только 1 инъекцию лекарства в кровь за всю жизнь!
 Тут нужно разобраться, где инженерия, где терапия.
Тут нужно разобраться, где инженерия, где терапия.
Поэтому, если мы говорим о трансляции исследований по продлению жизни на человека, то генная терапия имеет абсолютное преимущество, поскольку не снижает качество жизни из-за необходимости постоянного лечения — соблюдать ежедневно определенную диету или же постоянно употреблять геропротекторы или другие лекарства.
Открытие теломеразы — революция в исследованиях старения
Идее использовать теломеразу для продления жизни уже больше 30 лет. Открытие теломеразы в 1985 году вызвало настоящий фурор среди исследователей старения, и было оценено так высоко, что за него Элизабет Блэкбёрн, Кэрол Грейдер и Джеку Шостаку в 2004 году дали Нобелевскую премию.

История исследований теломеразы уходит корнями еще в 1961 год. Американский исследователь Леонард Хейфлик культивировал фибробласты эмбриона человека в пробирке и заметил, что они способны поделиться не более 50 раз, после чего стареют. А если брать клетки более старых доноров, то делятся они и того меньше. Ученый предположил, что в клетках существует некий счетчик делений, ограничивающий их общее число.
Спустя 10 лет российским ученым Алексеем Оловниковых был предложен гипотетический механизм работы этого счетчика. Оловников предположил, что при делении клеток концы хромосом, называемые теломерами, немного сокращаются. А когда теломеры достигают критической длины, клетка перестает делиться и стареет. В нестареющих клетках (например, половых и эмбриональных стволовых), напротив, должен существовать фермент, который удлиняет теломеры, позволяя клеткам делиться практически до бесконечности.
Эта гипотеза полностью подтвердилась с открытием фермента — теломеразы в 1985 году. Стали накапливаться данные о роли теломер и теломеразы не только в старении клеток, но и старении целого организма. Кроме того, было показано, что повреждение гена теломеразы сильно сокращает жизнь модельных животных и приводит к возникновению синдрома преждевременного старения — прогерии.

После открытия теломеразы десятки ученых загорелись тем, чтобы сделать на ее основе лекарство от старости. Казалось бы, «включение» теломеразы во всех клетках может сделать организм бессмертным.
Однако вскоре возникли опасения в связи с тем, что активный синтез теломеразы наблюдается и в 90% раковых опухолей. Встал вопрос: не приведет ли активация теломеразы к риску злокачественной трансформации? Кроме того, оказалось, что старение клеток далеко не всегда сопровождается сокращением теломер. Например, в случае эпителиальных клеток слизистой полости рта или роговицы глаза человека. Это говорило о том, что одной активации теломеразы может быть недостаточно для омоложения всего организма.
Несмотря на сомнения, которые вызывало терапевтическое применение теломеразы, начались эксперименты на клеточных линиях и модельных животных. Были проведены десятки исследований, и результаты превзошли все ожидания.
Генная терапия теломеразой на клеточных линиях
В ряде исследований работа теломеразы была активирована в человеческих клетках в пробирке (in vitro). Такие работы, с одной стороны, позволяют больше узнать о свойствах теломеразы, а с другой — являются первым шагом в разработке лекарства, продлевающего жизнь.
Для этого в ДНК клеток встраивают ген каталитической субъединицы теломеразы (TERT). Именно она осуществляет удлинение теломер в клетке.

Первое успешное исследование по доставке гена TERT было проведено в 1998 году Андреай Боднар с коллегами. Оказалось, что при активации теломеразы фибробласты человека, которые в норме делятся не больше 75–80 раз, способны поделиться 280. При этом у них не возникает признаков старения, патологии или малигнизации (ракового перерождения). Даже если такие клетки пересадить бестимусным мышам — совершенно лишенным иммунитета и более подверженным раку — у них все равно не возникают опухоли.
В последующие годы были проведены десятки исследований, в которых ген теломеразы вводили в самые разные типы клеток человека. Доставка гена TERT в делящиеся клетки увеличивала их потенциал к пролиферации, а доставка в старые клетки — приводила к «омоложению» и возобновлению делений.
Успешные эксперименты были проведены на мезенхимальных стволовых клетках, стволовых клетках кости (остеобластах), миосателлитах (предшественниках мышечной ткани), суставных хондроцитах (предшественниках хрящевой ткани), а также — на клетках межпозвоночного диска, Т-лимфоцитах, гепатоцитах (клетках печени), клетках обонятельных луковиц и пр.
Важно отметить, что в подавляющем большинстве случаев доставка гена теломеразы была абсолютно безопасна. Клетки сохраняли свои функции, и не наблюдалось признаков опухолеобразования. Однако в некоторых работах введение гена TERT приводило к увеличению частоты хромосомных перестроек (разрывов хромосом, слипания, перемещения участков одной хромосомы на другую). Это, конечно, является фактором риска для возникновения рака, однако может не иметь негативных последствий.
В целом, результаты исследований говорят о том, что работа теломеразы в культуре клеток человека значительно замедляет старение и совсем не обязательно вызывает развитие рака. То есть теломераза лишена свойств онкогена, которые ей приписывали. Видимо, основным свойством теломеразы является регуляция клеточного деления, а для возникновения опухолевого роста необходимы дополнительные мутации и факторы.
Генная терапия теломеразой: от экспериментов на мышах к человеку
Впервые эксперименты по генной терапии старения были проведены в 2012 году испанской исследовательницей Марией Бласко с использованием гена теломеразы (TERT). Первые же полученные результаты были весьма и весьма впечатляющими. Генная терапия не только взрослых, но и старых мышей продлевала жизнь до 20%! Если представить, что подобных результатов можно будет достигнуть и на человеке — мы сбережем 14 лет человеческой жизни!
Перед тем как перейти к генной терапии, эффекты теломеразы исследовались на трансгенных мышах. Оказалось, что если «включить» ген TERT во всех клетках мыши, то продолжительность жизни увеличивается на 40%! Однако постоянная активность теломеразы увеличивала и риск рака.
Поэтому стал вопрос о том, как активировать работу теломеразы на более короткий срок.
Именно это было сделано в работе Марии Бласко 2012 года. Ген теломеразы доставлялся в организм мыши при помощи аденоассоциированного вируса (AAV9), способного обеспечивать системную доставку. Аденоассоциированные вирусы характеризуются высокой безопасностью: они не встраивают доставляемый ген в геном хозяина, и поэтому не приводят к мутагенезу. Кроме того, они почти не вызывают иммунный ответ.
Ген теломеразы был доставлен в широкий спектр тканей и органов, включая печень, почки, легкие, сердце, мозг и мышцы. Теломераза обнаруживалась в этих тканях даже спустя 8 месяцев после процедуры. У животных улучшился ряд возрастных параметров: чувствительность к инсулину возросла, улучшилась нервно-мышечная координация, снизился риск остеопороза (истощения костной ткани) и содержание молекулярных маркеров старения. Кроме того, терапия геном TERT оказалась совершенно безопасной: риск рака у мышей не увеличивался.
И, что самое важное, генная терапия существенно продлила мышам жизнь. Медианная продолжительность жизни (возраст, до которого доживает больше половины особей в группе) увеличилась у взрослых (1-летних) и старых (2х-летних) мышей на 24% и 13%, соответственно. Максимальная продолжительность жизни тоже возросла: на 13% у взрослых и на 20% у старых мышей.
В следующем исследовании Мария Бласко показала, что доставка гена TERT в сердце мышей после инфаркта миокарда значительно улучшает работу сердца и снижает риск сердечной недостаточности и смертность на 17%.
Благодаря этим экспериментам у генной терапии теломеразой сложилась блестящая репутация. И в сентябре 2015 года был проведен первый в мире эксперимент по генной терапии старения на человеке. Американка Элизабет Перриш ввела себе ген теломеразы в сочетании с геном ингибитора миостатина (для стимуляции роста мышц). Это исследование только началось, так что говорить о результатах пока рано, но пока Элизабет чувствует себя хорошо. Элизабет дала обещание предоставлять материал для анализов любым научно-медицинским учреждениям по запросу. Однако поскольку в этом эксперименте участвовал только один человек, его результаты не позволят сделать надежных, статистически значимых выводов.
Однако сам факт того, что начались испытания на людях, говорит о том, что лекарство на основе TERT уже на подходе. Оно без сомнения является кандидатом номер один для борьбы со старением при помощи генной терапии.
Генная терапия для омоложения гипоталамуса
Один из путей продления жизни — узконаправленное воздействие на структуры, регулирующие старение всего организма. Исследования последних лет показывают, что такой структурой является отдел мозга — гипоталамус.
В 2013 году американские ученые под руководством Доншенга Кая существенно продлили жизнь мышам, омолаживая гипоталамус при помощи генной терапии. Исследователи подавляли возникающее с возрастом воспаление в гипоталамусе, в результате чего снизилось число возрастных патологий, а продолжительность жизни увеличилась на 10%.

Старение во многом связано с нарушением гомеостаза — саморегуляции организма, его способности сохранять свое внутреннее состояние. В «молодом» состоянии организм реагирует на нарушающее равновесие воздействие комплексом мер, которые успешно возвращают его в исходное, «здоровое» состояние. Например, при увеличении температуры тела организм запускает ряд процессов терморегуляции (например, потоотделение), в результате которых температура снижается до исходного уровня. Однако при старении способность поддерживать гомеостаз нарушается, что приводит к «разбалансировке» организма.
Гипоталамус — один из главных центров организма, регулирующих гомеостаз. Несмотря на то, что он составляет не больше 5% мозга, именно он связывает в единую систему нервные и гормональные механизмы поддержания гомеостаза.
С возрастом работа гипоталамуса сильно ухудшается, в частности, снижается выработка важнейшего гормона — гонадолиберина. «Классическая» функция этого гормона — регулировать половую функцию. Но для старения это играет второстепенную или даже третьестепенную роль. Важно то, что гонадолиберин еще и активирует нейрогенез — образование новых нервных клеток в гипоталамусе, а также в ряде других областей головного мозга.
Одной из главных причин возрастного ухудшения работы гипоталамуса — является воспаление. С возрастом в гипоталамусе активируются транскрипционные факторы NF-kB и IKK-b — регуляторные молекулы, которые запускают работу целого каскада генов, ответственных за воспаление.
Для омоложения и снижения воспаления в гипоталамусе Доншенг Кай с коллегами использовал ген, ингибирующий работу NF-kB — IkB-a. Ген IkB-a вводили взрослым мышам при помощи инъекции в гипоталамус. Для того чтобы ген проник в ядра клеток и встроился в геном использовали лентивирусные векторы.
Терапия оказала очень сильный эффект на старение. Максимальная продолжительность жизни мышей увеличилась на 10%! Здоровье мышей также значительно улучшилось. Даже через 6 месяцев после инъекции у мышей были лучше умственные показатели, лучше работали мышцы. Анализ структуры тканей также показал, что мышцы, кожа и кости мышей были в более «молодом» состоянии.
Таким образом, гипоталамус — важный центр регуляции системного старения. Его омоложение приводит к продлению жизни организма, по-видимому, как за счет улучшения собственных регуляторных функций гипоталамуса и выделения половых гормонов, так и за счет стимуляции нейрогенеза и, как следствие, улучшения работы других отделов мозга.
Генная терапия для увеличения устойчивости к стрессам
Среди путей продления жизни, изученных к сегодняшнему дню, самым мощным является увеличение стрессоустойчивости. Именно за счет воздействий на этот путь поставлены все нынешние рекорды продления жизни. Роберту Шмуклеру-Рису удалось продлить жизнь нематоды в 10 раз, а Андржею Бартке жизнь мыши — в 1,8.
На протяжении жизни организм постоянно сталкивается с самыми разными повреждающими факторами: голодом, жаждой, холодом, токсическими веществами, повреждающим излучением, психологическим напряжением. Устойчивость к этим факторам и получила название — стрессоустойчивости.
Увеличение стрессоустойчивости может происходить на всех уровнях: начиная от молекул, кончая целым организмом. Однако изучены преимущественно молекулярные механизмы. Повышение стрес
