Электрохимический ликбез: электролиз

На GEEKTIMES популярны публикации, связанные с энергетикой, в том числе с получением водорода. Однако в обоих недавних случаях (1 и 2), да простят меня авторы, я плохо понимал, о чём речь, несмотря на профильное образование, пока не обратился к первоисточникам.
Ниже — мои пояснения читателям, чтобы было яснее, из-за чего у электрохимической науки существует необходимость в повышении энергоэффективности.
Итак, электролиз воды, т.е. разложение её на водород и кислород (1): 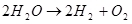 (1)
(1)
Учитывая, что это эндотермический процесс, т.е. протекающий с поглощением энергии, встаёт вопрос о его экономическом смысле. Он, правда, не в моей компетенции, но могу предположить, что смысл может быть, например, в том, чтобы использовать водород для хранения энергии.
При протекании электролиза возникает несколько видов энергетических потерь, связанных с химическими явлениями:
— низкий выход по току;
— износ электродов;
— перенапряжение.
Омические потери я не рассматриваю, так как они не связаны с химическими процессами.
1)Выход по току — это отношение количества электричества, израсходованного на образование целевого продукта (Qц), к общему количеству электричества (Qо), пропущенного через электроды. Выход по току может принимать значения от 0 до 1 или от 0% до 100%: 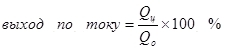
Выход по току менее 100% объясняется тем, что при электролизе очень часто протекают побочные реакции, которые не ведут к образованию желаемого продукта. Типичный пример — электрохимическое хромирование (а также цинкование в кислых электролитах, например), которое автору доводилось проводить в промышленных масштабах. Выход по току реакции образования металлического хрома (2, для дотошных: конечно, такая реакция на электроде не протекает, это упрощение) из стандартного сернокислого электролита не превышает 15–20% из-за того, что одновременно с нужной реакцией протекают реакции восстановления ионов водорода (гидроксония для особо дотошных) до водорода (3) и дихромат-ионов до ионов хрома (+3) (4). Когда говорят об эффективности электролиза, чаще всего имеют в виду именно этот показатель — выход по току. (2)
(2)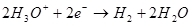 (3)
(3)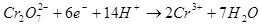 (4)
(4)
Выход по току зависит от множества факторов: состава и температуры электролита, материала и состояния электродов, силы тока и напряжения. Варьируя в определённых пределах эти параметры, можно оптимизировать расходы энергии на целевой электрохимический процесс.
Само же протекание побочных реакций связано с их термодинамической возможностью (см. ниже) и ненулевой скоростью (см. ниже).
2) Износ электродов — это материальные, а не энергетические потери. Однако для изготовления электродов тоже необходимо затрачивать энергию, поэтому я включил этот пункт. Чаще изнашиваются аноды — на них протекают процессы окисления. Катоды тоже могут разрушаться, если электролит достаточно агрессивен.
Стойкость анода есть функция от его состава и структуры, а также плотности тока.
3) Наиболее сложно для понимания третье явление — перенапряжение. Попробую объяснить его суть.
Чтобы стал возможен электролиз, необходимо подать на катод и анод определённую разность потенциалов. Минимально необходимая разность потенциалов считается с помощью уравнения Нернста (5): 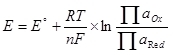 , (5)
, (5)
где
E — электродный потенциал полуреакции, В;
E° — стандартный электродный потенциал полуреакции, В;
R — газовая постоянная, 8,314 Дж/(моль×К);
T — температура, К;
n — число электронов, участвующий в полуреакции;
F — постоянная Фарадея, 96500 Кл/моль.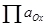 — произведение активностей (фугитивностей) окисленных форм;
— произведение активностей (фугитивностей) окисленных форм;  — произведение активностей (фугитивностей) восстановленных форм.
— произведение активностей (фугитивностей) восстановленных форм.
Так, электродный потенциал полуреакции (4) запишется в виде (6):  (6)
(6)
Вот пример.
При разложении воды (в кислых растворах) на аноде идёт окисление её до кислорода:  Eа°=1,36 В
Eа°=1,36 В
На катоде идёт восстановление её до водорода: 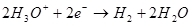 Eк°= 0 В
Eк°= 0 В
Минимальная разность потенциалов (ΔE), которую надо подать на электроды, чтобы начал протекать электролиз, составит ΔE = Eа — Eк. В случае воды это значение при стандартных условиях (активность ионов водорода 1, давление, для особо дотошных — фугитивность, кислорода и водорода 1 атм, тогда второй член уравнения Нернста равен 0 и E=E°) составит 1,36 В. Однако в реальности это напряжение часто больше на величину, называемую перенапряжением Δφ, которое, к тому же, зависит от плотности тока на данном электроде Δφ=f (j), материала электрода и состояния его поверхности.
Откуда берётся перенапряжение?
Причины возникновения перенапряжения — кинетические, т.е. связанные со скоростью протекания электрохимической реакции.
Рассмотрим реакцию, обратную электролизу воды: взрыв гремучего газа, т.е. смеси 2 объёмов водорода и 1 объёма кислорода. Реакция сопровождается выделением большого количества теплоты, однако при комнатной температуре не протекает из-за высокой энергии активации (обозначено Eа на рисунке ниже) — потенциального барьера, которого надо преодолеть прочным молекулам водорода и кислорода. Чтобы взрыв всё-таки произошёл, смесь необходимо поджечь, т.е. нагреть, повысив потенциальную энергию части молекул. Можно внести катализатор, например, мелкораздробленную платину, которая понизит энергию активации.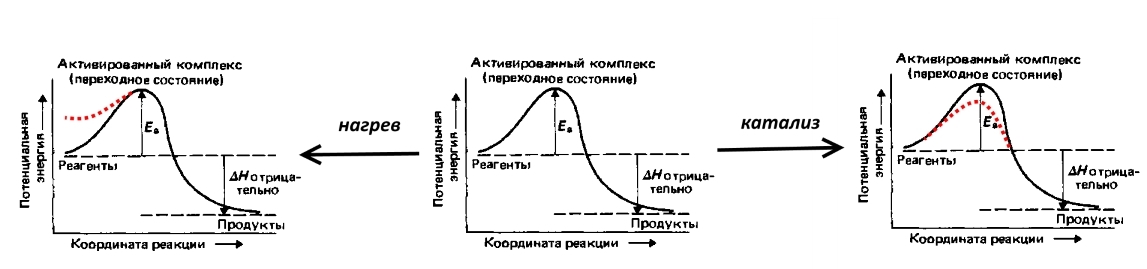
Перенапряжение — это электрохимический эквивалент энергии активации, она отражает те дополнительные (по сравнению с термодинамическими, рассчитанными по уравнению Нернста) энергетические затраты, которые надо преодолеть для того, чтобы скорость электролиза была высока.
У перенапряжения есть несколько составляющих.
В процессе электролиза приэлектродный слой обедняется теми ионами, которые разряжаются на соответствующем электроде. Таким образом, значения концентраций, которые надо подставлять в уравнение Нернста, не соответствуют тем, которые наблюдаются в объёме электролита, а, значит, и разность потенциалов, при которой будет продолжаться электролиз, увеличится. Такое перенапряжение называется концентрационным. В случае концентрационного перенапряжения дополнительные энергетические затраты нужны для того, чтобы преодолеть последствия диффузионного, миграционного и конвективного переноса потнциалопределяющих ионов.
Концентрационное перенапряжение устраняется перемешиванием и повышением электропроводности электролита.
Вторая составляющая перенапряжения связана с протеканием химической реакции. Это может быть как обычная химическая реакция, идущая в приэлектродном слое или на поверхности электрода, процессы адсорбции-десорбции, так и электрохимическая реакция, связанная непосредственно с переносом электрона через границу раздела фаз с электрода на молекулу или ион. Такое перенапряжение иногда называют реакционным.
Если наиболее медленной стадией становится перенос электрона, говорят о наличии перенапряжении электрохимической стадии. В этом случае дополнительные энергетические затраты нужны для повышения энергии электронов материала электрода. Нужно повысить их потенциальную энергию до энергии соответствующих химических связей реагента и облегчить их туннелирование к реагенту, находящемуся в приэлектродном слое.
Третья составляющая перенапряжения, фазовая, появляется в том случае, если электролиз связан с образованием новой фазы — пузырьков газа или плёнки металла. Дополнительные энергетические затраты в данном случае нужны для преодоления силы поверхностного натяжения на стадии образования зародышей новой фазы. Снять фазовое перенапряжение помогают добавки к электролиту поверхностно-активных веществ.
Теперь вернёмся к статье, которая обсуждалась на GEEKTIMES, чтобы расшифровать её смысл.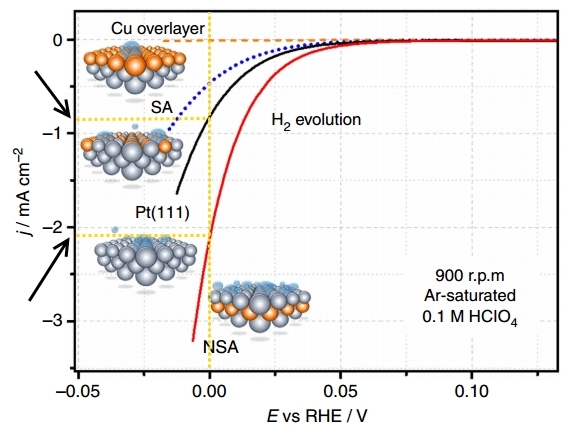
На рисунке представлены поляризационные кривые — зависимости плотности тока (j) от потенциала (E, относительно RHE, т.е. обратимого водородного электрода) на различных электродах при выделении водорода (H2 evolution).
Поляризация — это разность между равновесным потенциалом электрода (т.е. в отсутствие тока) и его потенциалом под током, т.е., грубо говоря, перенапряжение для отдельного электрода. На графике выше — это поляризация электрода, на котором происходит выделение водорода. Плотность тока в электрохимии — это способ выражения скорости химической реакции. Таким образом, чем больше плотность тока при меньшем перенапряжении (поляризации), тем лучше, т.е. тем быстрее идёт процесс и тем меньше энергетических затрат на его осуществление.
Сравним плотность тока при E=0 В для платинового немодифицировннаого электрода Pt (111) и модифицированного подслоем меди электрода NSA. На модифицированном электроде в единицу времени выделяется примерно в 2 раза больше водорода.
Теперь посмотрим на проблему с другой стороны. Первоначально статья на GEEKTIMES была озаглавлена как «Эффективность электролиза увеличили вдвое». Как я писал выше, часто под эффективностью при электролизе подразумевают выход по току. Часто, но не всегда.
Существует понятие КПД электролиза, которое учитывает перенапряжение (как сумму модулей поляризаций) (7): 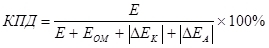 , (7)
, (7)
где
E — напряжение, подаваемое на электроды, В;
Eом — омическое падение напряжения, В;
ΔEK — катодная поляризация, В;
ΔEA — анодная поляризация, В.
С этой точки зрения снижение перенапряжения, безусловно, повышает эффективность электролиза. Другое дело, что для вычисления КПД электролиза в обсуждаемом случае нужно, скорее всего, провести дополнительные измерения и расчёты, которые покажут, что модифицированный подслоем меди электрод увеличить КПД в 2 раза не смог.
Ну и немножко теории в заключение.
Если концентрационное перенапряжение можно понизить перемешиванием и увеличением электропроводности раствора, фазовое — добавками поверхностно-активных веществ, то реакционное перенапряжение, связанное с протеканием химической реакции, устраняется применением катализаторов. В рассматриваемом случае таким катализатором стал подслой меди на платиновом электроде.
Выделение водорода при электролизе воды связано с обрзованеим промежуточных частиц — атомов водорода, адсорбированных на электроде, так называемых адатомов. Для эффективного выделения водорода связь адатомов с поверхностью электрода не должна быть ни очень сильной, ни очень слабой. Из всех известных чистых металлов оптимальной энергией связи с адатомами водорода обладают платиноиды, вот почему на платине перенапряжение выделения водорода — одно из самых низких. Введение субслоя из атомов меди, как показывают расчёты, ещё несколько понижает энергию связи «поверхность электрода-адатом водорода», что усиливает каталитическую активность электрода, снижает перенапряжение и, соответственно, энергетические затраты, а также повышает скорость выделения водорода.
Спасибо за внимание.
