[Перевод] Улучшение работы батарей через химию
[* Название статьи является аллюзией на название первого студийного альбома Fatboy Slim, «Better Living Through Chemistry» / прим. перев.]

Свинцово-кислотный аккумулятор нельзя назвать чудом современной инженерной мысли. Он очень надёжен и прост в использовании, а для его зарядки нужно просто подать на него фиксированное напряжение и немного подождать; в итоге аккумулятор заряжается и остаётся полностью заряженным — вот и всё. На другой стороне этой простоты находятся их размер, вес, плотность энергии и токсичность материалов.
Литиевый аккумулятор — современный хит, однако его большая энергетическая плотность приводит к тому, что его корпус небольшого размера может разозлиться и стать весьма опасным при неправильном обращении. Учёные ищут более безопасные варианты аккумуляторов, улучшенные системы заряда, формулы для дольше работающих батарей, которые можно было бы перезаряжать тысячи раз, и одна недавняя публикация вызвала множество восторженных откликов.
Рассмотрим требования к аккумуляторной ячейке в электромобиле:
- Высокая плотность энергии (большое количество энергии в батарейке небольшого размера).
- Возможность быстрого заряда.
- Возможность быстрого разряда.
- МНОГО циклов зарядки/разрядки.
- Низкий саморазряд.
- Безопасность.
На текущий момент наилучшим вариантом являются литий-ионные аккумуляторы, однако химических реакций с применением лития есть предостаточно, и в зависимости от планируемого использования, балансировки и зарядки, можно оптимизировать различные варианты реакций под различные характеристики работы. Пока не существует идеальной батарейки, а конфликтующие запросы гарантируют наличие на рынке нескольких вариантов.
Как работает литий+ион
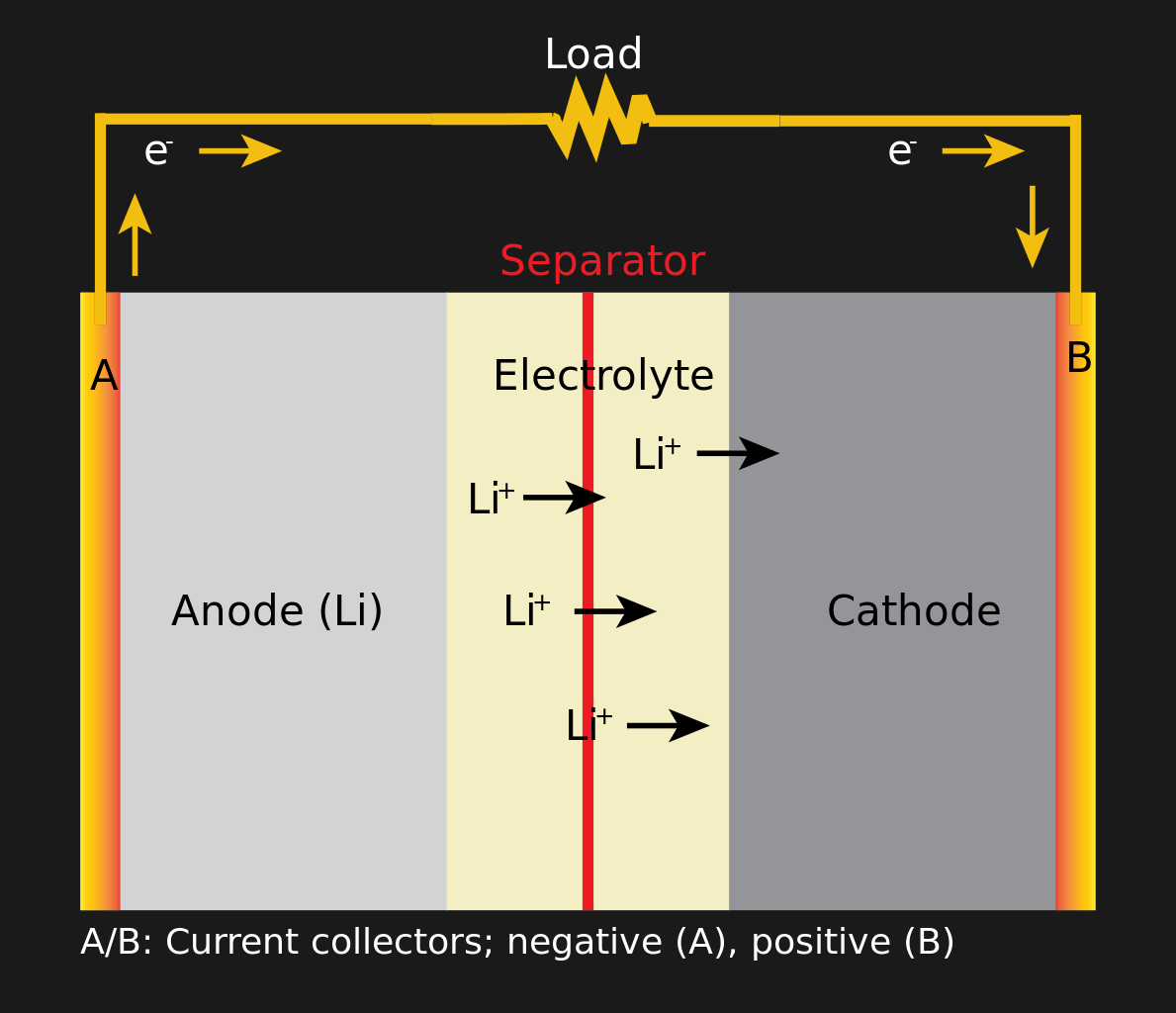
Разрядка литий-ионной батареи
Все аккумуляторы работают одинаково. Есть три компонента: анод, катод и электролит. Химическая реакция между электролитом и электродами (анодом и катодом) создаёт ионы рядом с одним электродом, и электроны рядом с другим, в результате чего возникает разность потенциалов. Пары электродов делаются из разных материалов. Анод — это графит, связанный с медью, а катод — кристалл лития, связанный с алюминием. Электролит работает подобием изолятора, поэтому электронам проще идти с одного электрода на другой через контур, чем внутри батареи. По окончанию реакции батарея разряжается, и реакция больше не будет идти, если электронам будет некуда податься. Для зарядки батареи процесс обращается вспять, и напряжение, подаваемое на электролит, запускает реакцию в другую сторону. Не все электролиты созданы равными; химия батарейки, которую нельзя перезаряжать, позволяет ей хранить больше энергии, но приложение обратного напряжения в ней не запускает химическую реакцию вспять.
Возможности аккумулятора лучше всего раскрываются за счёт увеличения площади поверхности электродов, поэтому сэндвич из анода, электролита и катода лучше делать как можно более тонким и с большей площадью соприкосновения. Также в сэндвич входят несколько ломтиков из других пористых материалов, пропускающих ионы, но не дающих мигрировать материалам. Возьмите несколько ваших аккумуляторных сэндвичей и сложите их вместе, перемежая разделителями. В итоге получится либо плоская батарейка (дешёвая ячейка в серебристом кожухе), либо призматическая батарейка (модная батарея, которую вы не встретите в ноутбуке), либо, если вы скрутите всё это в трубочку — цилиндрическая батарейка (к примеру, 18650, или АА).
Аккумулятор на миллион миль
Возможно, вы уже читали новость о том, что Tesla обещает выпустить батарейку, срока жизни которой хватит на «миллион миль». Реально работу выполняла группа исследователей из Университета Далхаузи в Галифаксе (Канада) по контракту с Tesla, однако они провели очень много тестов различных Li-ion аккумуляторов, чтобы найти наилучшее сочетание химических элементов, а также профилей использования и зарядки. «Батарейка на миллион миль» — это просто маркетинговая завлекалочка, описывающая исследования, оптимизирующие химические формулы батарей для увеличения их времени жизни. Сама работа заполнена техническим жаргоном, поэтому я все выходные изучал вопрос аккумуляторов, чтобы сделать вам выборку.
Первое, что стоит отметить касательно их формулы «на миллион миль» — она не характерна для поведения большей части сегодняшних водителей, средних владельцев авто, ездящих на работу и домой. Учёные нацелились на такое использование автомобиля, которое предполагает постоянные поездки и зарядки батареи после почти полной разрядки. Такая ситуация подойдёт для грузовиков, такси и автобусов. Они используют термин 100% DOD, т.е. «глубину разряда» — это когда батарейку используют до упора, а только потом заряжают, в отличии, к примеру, от смартфона, который ставят на зарядку каждый вечер вне зависимости от состояния аккумулятора.
Что обнаружилось: батарейки любят холод; горячие новые формулы
Они нашли, что очень большое значение имеет температура. Аккумулятор, работавший большую часть жизни при температуре в 20 ºC, будет жить дольше, чем тот, что работал при 40 ºC; однако батарейки, работавшие при высоких температурах, а затем попавшие в условия низких, теряют ёмкость с той же скоростью, что и батарейки, всегда работавшие при низкой температуре. Иначе говоря, при высокой температуре батарейка быстрее теряет ёмкость, а при низкой она теряет её не так быстро, и любая батарейка может перемещаться на этом графике туда и сюда без какого бы то ни было эффекта памяти. Более низкие температуры обеспечивают низкую скорость деградации на молекулярном уровне — меньшее количество трещин, дендритов, газовых карманов и т.п. Они очень сильно упирали на то, насколько важно держать всё при низкой температуре.
В предыдущих экспериментах исследователи много времени потратили на изучение других сочетаний химических элементах, но остановились на графитовых электродах NMC532 (как и большая часть научного сообщества). В химии NMC532 — это другое название для LiNi0.5Mn0.3Co0.2O2. Простым языком это значит, что катод в основном состоит из кристаллов лития, с добавлением небольшого количества никеля, марганца, кобальта и кислорода, а анод состоит из графита (хотя исследования графена выглядят многообещающе).
Однако характеристика NMC532/графит не является исчерпывающей для аккумулятора. Нужно ещё указать электролит. Электролит — это смесь из LiPF6, растворителей и добавок, с названиями слишком смешными для того, чтобы произносить их вслух — типа диметил карбоната или этилен сульфата. В этой работе они проверяли несколько комбинаций растворителей. Добавки также могут влиять на производительность ячейки, увеличивая скорость зарядки/разрядки за счёт укорачивания времени жизни, или наоборот. На основе предыдущих исследований им очень нравились две формулы добавок (2%FEC+1%LFO, and 2%VC+1%DTD), хотя они обнаружили, что при разных температурах они ведут себя по-разному, и предложили выбирать добавки согласно предполагаемому применению. При производстве аккумуляторов обычно сначала делают сухие компоненты, к которым потом добавляют жидкий электролит (Sparkfun делали подробную статью с описанием производственного процесса).
Выбрав особую формулу и поддерживая низкую температуру работы, исследователи смогли минимизировать две основные причины деградации батареи; потерю лития и увеличение импеданса. В среднем со временем ионы лития, двигаясь туда и сюда, залезают в такие места, которые не позволяют им работать. Они могут оказаться электрически изолированными, группироваться в пластины, дендриты и поверхностные плёнки, реагировать с другими компонентами ячейки, и не участвовать в зарядке и разрядке. Особенно вредными оказываются дендриты — эти кристаллы в виде острых литиевых иголок могут прокалывать сепараторы и закорачивать ячейку, которая затем разогревается и приводит к самоподдерживающейся реакции, и в итоге — к взрыву. Импеданс увеличивается из-за коррозии электродов и потере полезной площади поверхности, из-за химических реакций, растрескивания или формирования резистивного поверхностного слоя, блокирующего электрод.
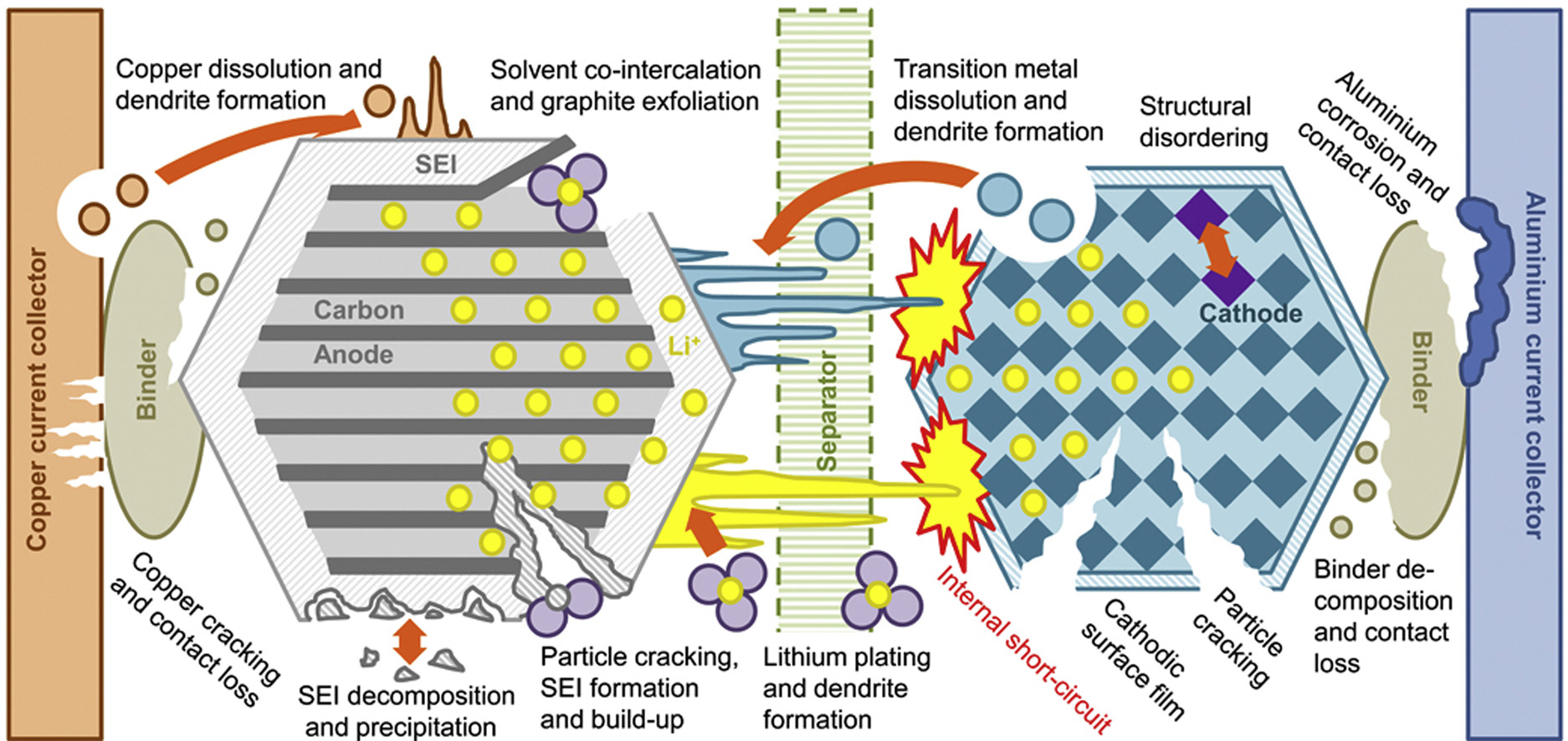
Способы деградации батареи. Их много, но по сути они сводятся к тому, что «атомы передвигаются туда, куда не надо»
Одна из причин, по которой их исследование привлекло повышенное внимание — оно было скрупулёзным и открытым. Оно заняло три года, для него потребовалось прогнать каждый аккумулятор через тысячи циклов зарядки и разрядки при помощи чрезвычайно точных зарядных и разрядных устройств, записывающих ёмкость батареи — и всё для того, чтобы получить наиболее полные данные. Обычно довольно трудно измерять жизненный цикл батареи в ускоренном режиме; батареи подвергаются большим скоростям зарядки/разрядки, чем требуется в обычной жизни, и получают меньше времени на восстановление. То, что исследователи потратили столько времени на свою работу, говорит о более реалистичных результатах. Они также явно указали:
В отличие от отчётов, описывающих использование коммерческих ячеек, мы включили полное описание всех деталей своих батарей, включая состав электродов, состав электролита, используемых добавок и т.п. Это сделано для того, чтобы другие люди смогли воспроизвести эти ячейки и использовать их для собственных проверок.
Приятно для разнообразия видеть исследование с коммерческой поддержкой, выложенное в открытый доступ, да ещё и под лицензией Creative Commons.
Несмотря на открытость работы, мы, вероятно, не увидим в ближайшее время Li-ion аккумуляторов домашнего изготовления. Возможно, мы увидим постепенный переход на предложенные формулы, и мы хотели бы, чтобы больше влияния уделялось охлаждению, поскольку это значительно увеличивает время жизни батарей. Уверены, что если вам понадобится аккумулятор, Tesla вскоре сможет продать его вам с одной из своих гигафабрик.
